医脉通编译,转载请注明出处
近期 JAMA Oncology 上发表了一项研究。该研究通过分析 PICCOLO 研究的患者,考察了 AREG 和 EREG 在经治的 CRC 患者接受帕尼单抗治疗的疗效方面的预测作用。研究显示,AREG 可独立预测帕尼单抗的疗效,而 EREG 的预测效果较差。相关述评则认为尽管研究中 EREG 高表达患者数量较少,EREG 方面的结论仍需探讨,但研究人员建立相当有效的模型,研究值得赞扬。医脉通报道。
2015年,由于 ASCO 和 ESMO 发表了癌症治疗方案的概念价值框架,关于肿瘤基础药物开发的成本收益分析再次受到人们的重视。同时作为精准医学计划的一部分,国家癌症研究所(NCI)划拨了7千万美元用于肿瘤基因组研究。这两个项目的目标是一致的,如果精准医学追求的是将对的药物用于治疗对的患者,那么使用预测生物标志物更精确的区分和选择患者将能使成本降低,提高医疗卫生系统的价值。
对生物标志物的发掘是目前所面临的挑战,仅有不到5%的肿瘤预测生物标志物得到了充分的技术上的验证并适合被临床采纳。个中原因十分复杂,包括缺乏标本收集和处理方法的标准,分析方法的可变性,临床试验患者群的异质性及动力不足等。然而,对已明确具有预测能力的生物标志物的进一步探索将能带来明确的获益,这已经在 EGFR 经治的晚期结直肠癌(CRC)患者进一步进行 RAS 基因分型方面得到了验证。
近期在 JAMA Oncology 上发表的一篇研究中,Seligmann 团队通过对帕尼单抗、伊立替康和环孢素治疗结直肠癌的结局研究(PICCOLO 研究)中的患者进行分析,证明了 AREG(NM_001657.3)和 EREG(NM_001432.2)基因表达水平对治疗结局的预测和预后作用。该研究是一项大型随机Ⅲ期临床试验,给予经治的晚期 CRC 患者盐酸伊立替康或伊立替康+帕尼单抗。由于 AREG 和 EREG 是EGFR 的配体,直观上看,它们作为 EGFR 通路抑制剂的可能的预测生物标志物是可靠的。然而之前的多个研究已经相当一致的显示 AREG 和/或 EREG 对接受抗 EGFR 治疗的 CRC 患者的生存具有预测作用,但并未得到肿瘤界的进一步推广。在这项研究中,研究者在过往研究结果的基础上,采用了一种新的方法对这两种生物标志物对预后的作用进行了综合。
研究对 PICCOLO 研究中高配体表达(两种配体有一种处于最高三分位)的患者的预后与剩余患者(低表达组)的预后进行了比较。研究人员发现,在 AREG 或 EREG 或均高表达的患者中(高表达组),帕尼治疗有更好的获益。该组中 RAS 野生型的患者接受伊立替康+帕尼单抗的无进展生存(PFS)为8.3个月,仅接受伊立替康的患者 PFS 为4.4个月(风险比 HR=0.38,95%CI 0.24-0.61,P<0.001),而低表达组患者接受帕尼单抗无显著的生存差异。此外,高表达组中 RAS 野生型患者接受帕尼单抗+伊立替康的缓解率也高于单用伊立替康的患者(47.7% vs. 18.9%)。但是这类患者接受帕尼单抗仅有改善总生存的趋势,并未达到统计学显著。然而由于原始试验中总生存的结果是阴性的,因此仅有改善趋势可能也并不奇怪。
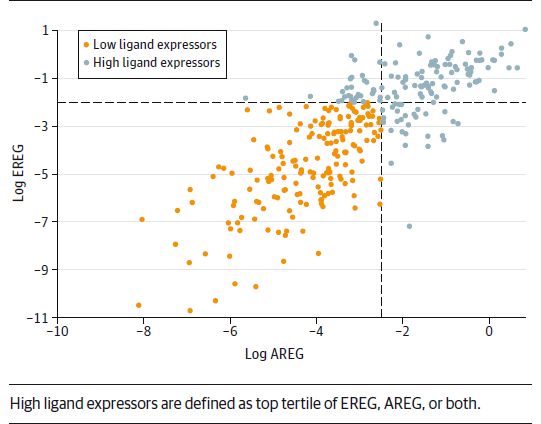
分组方案
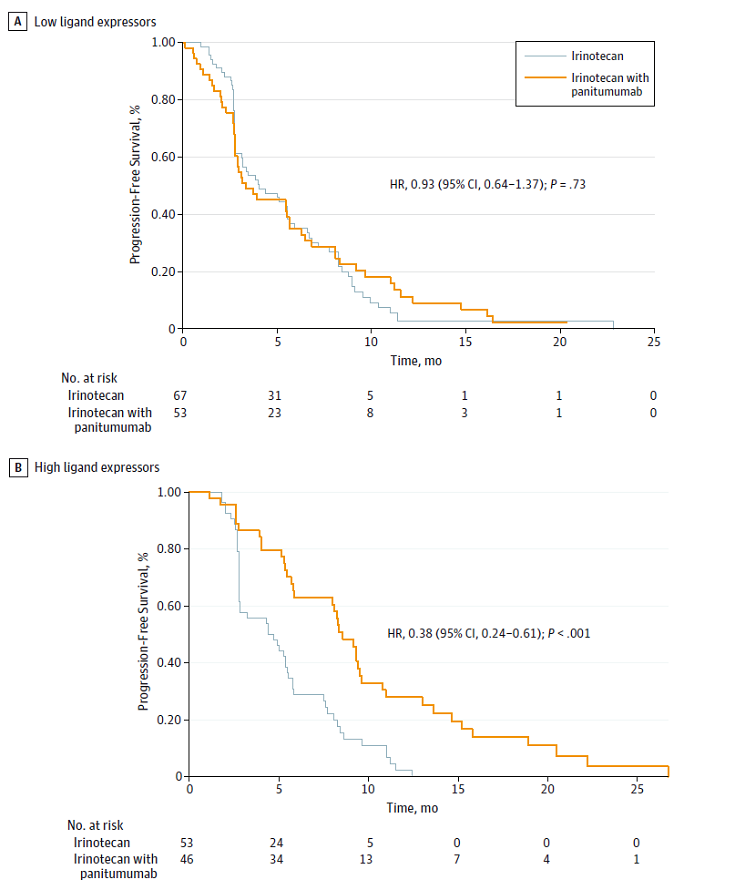
两组接受帕尼单抗的 PFS 数据
AREG 和 EREG 是连续变量,单纯通过定义将患者按三分位数或类似分法对患者分层将会减少信息内容,比如配体表达与预后之间可能是一种比较平稳的相关性。评估此类变量的传统方法是用连续性方式评估它们对生存的作用,而该研究将此类分析作为次要终点进行了分析。分析结果显示,AREG 表达对帕尼单抗的获益有强预测作用,而 EREG 的影响则达不到统计学显著。研究结果同时显示,AREG 表达作为连续变量的预测作用独立于潜在的混杂因素,包括 BRAF 情况和肿瘤位点,但 EREG 表达的预测作用并不独立。两种配体的不同作用在生存结局方面获得了确认:高 AREG 表达的患者接受帕尼单抗治疗有显著的 PFS 改善(HR=0.30,95%CI 0.17-0.52,P<0.001),而仅有高 EREG 表达的患者并没有显著的生存获益(HR=0.82,95%CI 0.32-2.09,P=0.68)。而仅有一种生物标志物处于高三分位数的患者接受帕尼单抗的 PFS 获益在获益大小和显著性方面均低于两种均高的患者(HR=0.6,95%CI 0.30-1.22,P=0.16),意味着获益主要发生在高 AREG 表达患者中。
因此,一个合理的问题便是 EREG 是否还应该被纳入在任何预测模型中。而另一方面,多个进行良好的回顾性分析显示,不仅 AREG 具有预测作用,EREG 同样具有预测作用。而 Seligmann 团队的这项研究中,高 EREG 表达的患者数量又较少(仅23例)。要判断 EREG 是否能作为预测生物标志物,这个数量太少了。
除了样本量较少之外,该研究的另一个局限性在于高 AREG 表达与总生存获益缺乏相关性。该研究的结果虽然令人很感兴趣,但是不足以改变目前的临床实践。然而这也并不意味着这两种生物标志物缺乏临床价值。在该领域上一个相似研究已经过去了将近10年的时候,这项研究的研究人员在建立模型方面向前迈进了重要的一步,而这一模型合理的利用了所有患者的 AREG 和 EREG 的信息。而未来只需要更多的收集相似的数据以确认这两种生物标志物是否具有预测的作用。而在抗 EGFR 治疗转移性 CRC 领域有大量的临床试验,研究者们应当进行合作,从而在生物标志物方面获得进展。
未来对于确证性工作的结果的解读还应该依赖于治疗环境。在英国,一线以外使用抗 EGFR 治疗的全权委托资金已被撤除。然而,如果能够找到一种具有确定性的预测因子,能够确定某一类患者二线接受抗 EGFR 治疗能够获得显著的生存获益,可以想象资金申报将会成功。例如,如果大约50%的晚期 CRC 患者是 RAS 野生型的,而其中又有43%的患者有高 AREG 和/或 EREG 表达,那么将有21%的患者适于治疗。虽然能够接受治疗的患者减少了一半以上,但是对于这些患者,抗 EGFR 治疗的治疗价值显著提高了。相反的,在资源无限制的资金环境下,AREG 和 EREG 情况的预测作用可能又有另外一种解释,而阴性预测价值方面的研究可能更有价值。
无论这些表达特征未来是否应用于临床,研究人员也应因他们在这一领域进行的努力和获得的进展而获得赞扬。对2个高度相关的且连续表达的生物标志物进行临床可用的二分的预测检验设计是非常具有难度的。尽管目前该模型还需进一步验证,但它已经使我们对晚期 CRC 患者的抗 EGFR 治疗有了更进一步的理解。
