根据WHO分级,Ⅱ级的脑胶质瘤为低级别浸润胶质瘤,包括星形细胞瘤和少突神经胶质瘤。它们占全部原发脑肿瘤的5%,胶质瘤的15%。发病率最高的年龄在35岁到44岁之间。
由于肿瘤位置的不同,表现出的临床症状也各异。80%的患者可能会出现癫痫,其他症状包括头痛、局灶性神经缺陷、认知能力改变、行为改变等等。有很多患者常常没有临床症状,无意中发现颅内占位。
低级别胶质瘤生长比较缓慢,中位总生存期(OS)根据亚型的不同,在4-13年间。绝大多数的肿瘤会进一步恶变后,最终导致患者死亡。
治疗方法包括手术、放疗(RT)、化疗等。鉴于病程较长,低级别胶质瘤的优化管理仍存在很多争议。而优化管理的目的是确定的:改善OS、延缓肿瘤恶变、维持较好的生活质量、最小化治疗后遗症。
所以,低级别胶质瘤的治疗需要根据组织学和分子学特征、是否存在一些危险因素进行综合考虑。
分类
低级别胶质瘤是一组形态学各不相同的肿瘤。最近的基因分析发现了一些分子标志物,在胶质瘤分类中也起到了重要作用。
星形胶质细胞瘤和少突神经细胞瘤是低级别胶质瘤的两个最常见的亚型。少突神经细胞瘤在2016年WHO新分类中已经被去掉,新版的分类应用组织学和分子学特征合并进行定义。
IDH1和IDH2是低级别胶质瘤中最常见的突变基因,大概发生率在70%以上。IDH突变是胶质瘤发病早期的驱动基因,提示预后较好。
之后应用其他分子学标志物对少突神经细胞瘤和星形胶质细胞瘤进行区分。1p/19q缺失几乎仅在少突神经细胞瘤种可见。CIC/FUBP1也在少突神经细胞了中可见,如果它们没有表达,提示复发较早,预后较差。
低级别的星型胶质细胞瘤会伴有TP53的突变和ATRX的失活,在少突神经细胞瘤中非常罕见。
TCGA里程碑式的研究应用低级别胶质瘤的分子标志物结果,应用IDH突变和1p/19q联合缺失的状态对低级别胶质瘤进行了有效区分。
IDH突变同时1p/19q联合缺失的患者预后最好,中位OS为8年。反之,IDH突变,1p/19q没有缺失(星型细胞瘤)的患者中位OS为6.4年。IDH野生型的低级别胶质瘤患者中位OS为1.7年,与IDH野生型的胶质母细胞瘤生存时间相似。
手术
手术切除是低级别胶质瘤的主要治疗方法之一。手术治疗时机也是争论的话题之一。过去一般讲,有症状患者可以较早手术,无意发现肿瘤的无症状患者可以先进行观察等待。
但是,最近已有回顾性的证据表明,较早手术可以提高患者的生存结局。穿刺活检容易误诊,应用手术切除组织进行活检要比穿刺活检的结果准确。
另外,有临床证据表明,扩大切除也可以提高患者的无进展生存(PFS)和OS。一项关于低级别胶质瘤切除范围的研究表明,>90%扩大切除患者的5年OS达97%,而<90%扩大切除的患者5年OS仅为76%。
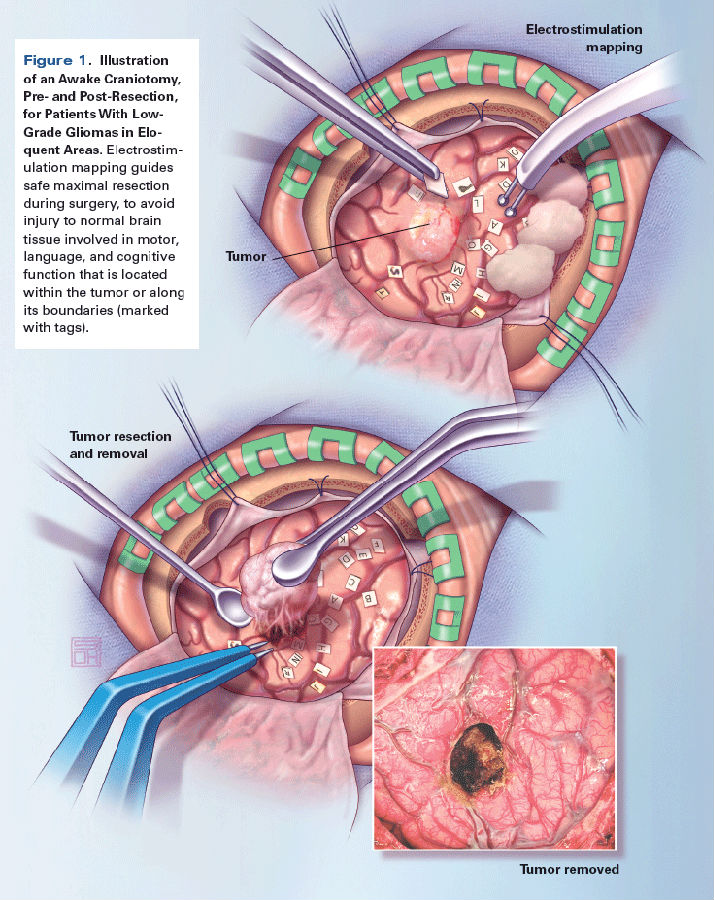
唤醒麻醉术中的直接电刺激(见上图)也可以改善患者的临床结局,由于其为扩大切除提供了便利条件,也能最小化切除时对功能区造成的损伤。
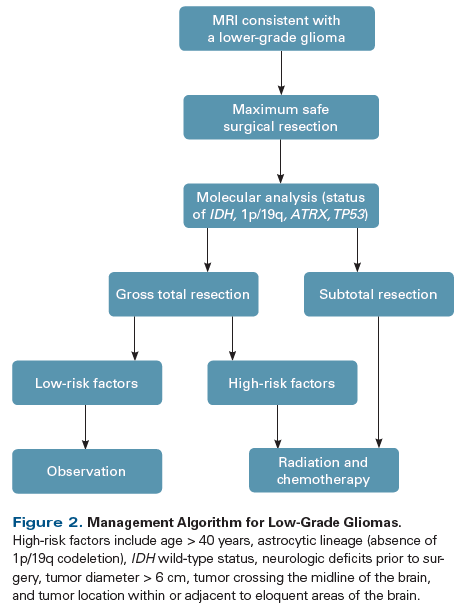
所以,低级别胶质瘤的首选管理手段就是最大安全切除,而不是观察等待。(上图示低级别胶质瘤的管理流程)
放化疗
低级别胶质瘤术后放化疗的优化使用标准也未完全明了。一些预后危险因素可以提示哪些患者肿瘤恶变概率较高,可能从辅助放化疗中获益。
除了IDH状态之外,其他的高危因素包括:年龄>40岁、次全切除/仅活检、星型胶质瘤(1p/19q联合缺失)、术前神经缺陷、肿瘤位置临近功能区等。
如果患者没有这些高危因素,相对风险较低。在完全切除术后,应进行3月一次的MRI随访,如果1年内没有肿瘤生长迹象,可以再进行一年4月1次的随访,最后拉大为每半年一次。
放疗
数十年来,放疗是低级别胶质瘤管理策略的重要组成部分之一。尽管对于时机和剂量的优化在持续的进行着。
EORTC发表了一项低级别胶质瘤术后放疗和进展后放疗对比的临床研究,结果表明二者OS未见明显差异(7.4年 vs 7.2年),但是早接受放疗患者的癫痫状况控制较好,中位PFS也有显著获益(5.3年 vs 3.4年)。
另一项EORTC研究评估了高剂量(59.4Gy)和低剂量(45Gy)放疗在低级别胶质瘤中的疗效差异,结果表明两组的PFS和OS未见显著差异,低剂量放疗组的生活质量更高。
放疗既有急性毒性,也有慢性毒性,包括疲乏、认知功能下降、血管病变、内分泌病、诱导第二原发癌等等,所以建议仅在高危的低级别胶质瘤中应用。
质子治疗:这种新型的放疗手段应用更重的粒子进行放疗,使剂量分布更加准确,正常组织保护的更好,进而减少了相关不良反应。质子治疗对于年轻的低级别胶质瘤患者来说比较有“吸引力”。
但是质子治疗的长期疗效和毒性还未被试验证实。但是,已有回顾性和前瞻性研究表明,质子治疗后的患者没有认知能力下降,不良反应包括斑秃、疲乏、神经内分泌障碍等。
但是质子治疗的费用在标准放疗的2倍以上,尚没有卫生经济学的研究数据发表。
同步放化疗
尽管在复发的患者中,同步放化疗的证据非常充足,但是低级别胶质瘤术后同步放化疗的争议非常大。
最近,对比在高危低级别胶质瘤中放疗和同步放化疗(化疗应用PVC)疗效的Ⅲ期临床试验RTOG 9802结果公布。
结果表明,同步放化疗组的中位OS为单纯放疗组的近2倍(13.3个月 vs 7.8个月)。值得注意的是,两组数据差异仅在长期随访后才能得出。
根据这一关键结果,高危的低级胶质瘤患者也应该接受同步放化疗,而非单纯放疗。
RTOG 9802应用的是PCV方案,但是在临床实践过程中,患者更容易接受替莫唑胺治疗。
但是,现在没有替莫唑胺和PCV头对头对比的研究结果公布。现在正在进行的CODELⅢ期研究目的为探究1p/19q联合缺失的,WHO Ⅱ或Ⅲ级胶质瘤患者中,放疗序贯PCV与放疗同步+序贯替莫唑胺的有效性和安全性。
结论
低级别胶质瘤是一种生长缓慢的,浸润性的,最终均会恶变的原发颅内肿瘤。
标准治疗包括最大安全切除、对高危患者的同步放化疗、终生的影像学随访。
治疗目标包括延迟恶变、生活质量最大化。低危的低级别胶质瘤管理方法没有明确标准。
随着肿瘤分子生物学的发展,应对低级别胶质瘤的风险分层和预后预测做进一步的探索。
希望能探索出更多的新型、个体化治疗手段,使疗效更好,毒性更低。
参考文献
1. Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. 2016;131:803-20.
2. Ostrom QT, Gittleman H, Fulop J, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2008-2012. Neuro Oncol. 2015;17(suppl 4):iv1-iv62.
3. Ruda R, Bello L, Duffau H, Soffietti R. Seizures in low-grade gliomas: natural history, pathogenesis, and outcome after treatments. Neuro Oncol. 2012;14(suppl 4):iv55-iv64.
4. Schomas DA, Laack NN, Rao RD, et al. Intracranial low-grade gliomas in adults: 30-year experience with long-term follow-up at Mayo Clinic. Neuro Oncol. 2009;11:437-45.
5. van den Bent MJ. Practice changing mature results of RTOG study 9802: another positive PCV trial makes adjuvant chemotherapy part of standard of care in low-grade glioma. Neuro Oncol. 2014;16:1570-4.
6. Yan H, Parsons DW, Jin G, et al. IDH1 and IDH2 mutations in gliomas. N Engl J Med. 2009;360:765-73.
7. Houillier C, Wang X, Kaloshi G, et al. IDH1 or IDH2 mutations predict longer survival and response to temozolomide in low-grade gliomas. Neurology. 2010;75:1560-6.
8. Wesseling P, van den Bent M, Perry A. Oligodendroglioma: pathology, molecular mechanisms and markers. Acta Neuropathol. 2015;129:809-27.
9. Bettegowda C, Agrawal N, Jiao Y, et al. Mutations in CIC and FUBP1 contribute to human oligodendroglioma. Science. 2011;333:1453-5.
10. Chan AK, Pang JC, Chung NY, et al. Loss of CIC and FUBP1 expressions are potential markers of shorter time to recurrence in oligodendroglial tumors. Mod Pathol. 2014;27:332-42.
11. Sahm F, Reuss D, Koelsche C, et al. Farewell to oligoastrocytoma: in situ molecular genetics favor classification as either oligodendroglioma or astrocytoma. Acta Neuropathol. 2014;128:551-9.
12. Cancer Genome Atlas Research Network, Brat DJ, Verhaak RG, et al. Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas. N Engl J Med. 2015;372:2481-98.
13. Jakola AS, Myrmel KS, Kloster R, et al. Comparison of a strategy favoring early surgical resection vs a strategy favoring watchful waiting in low-grade gliomas. JAMA. 2012;308:1881-8.
14. Muragaki Y, Chernov M, Maruyama T, et al. Low-grade glioma on stereotactic biopsy: how often is the diagnosis accurate? Minim Invasive Neurosurg. 2008;51:275-9.
15. Sanai N, Berger MS. Glioma extent of resection and its impact on patient outcome. Neurosurgery. 2008;62:753-64.
16. Duffau H. Surgery of low-grade gliomas: towards a ‘functional neurooncology.’ Curr Opin Oncol. 2009;21:543-9.
17. Smith JS, Chang EF, Lamborn KR, et al. Role of extent of resection in the long-term outcome of low-grade hemispheric gliomas. J Clin Oncol. 2008;26:1338-45.
18. Sanai N, Mirzadeh Z, Berger MS. Functional outcome after language mapping for glioma resection. N Engl J Med. 2008;358:18-27.
19. Duffau H, Gatignol P, Mandonnet E, et al. Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with grade II glioma in the left dominant hemisphere. J Neurosurg. 2008;109:461-71.
20. Pignatti F, van den Bent M, Curran D, et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol. 2002;20:2076-84.
21. Daniels TB, Brown PD, Felten SJ, et al. Validation of EORTC prognostic factors for adults with low-grade glioma: a report using intergroup 86-72-51. Int J Radiat Oncol Biol Phys. 2011;81:218-24.
22. Chang EF, Smith JS, Chang SM, et al. Preoperative prognostic classification system for hemispheric low-grade gliomas in adults. J Neurosurg. 2008;109:817-24.
23. van den Bent MJ, Afra D, de Witte O, et al. Long-term efficacy of early versus delayed radiotherapy for low-grade astrocytoma and oligodendroglioma in adults: the EORTC 22845 randomised trial. Lancet. 2005;366:985-90.
24. Karim AB, Maat B, Hatlevoll R, et al. A randomized trial on dose-response in radiation therapy of low-grade cerebral glioma: European Organization for Research and Treatment of Cancer (EORTC) study 22844. Int J Radiat Oncol Biol Phys. 1996;36:549-56.
25. Kiebert GM, Curran D, Aaronson NK, et al. Quality of life after radiation therapy of cerebral low-grade gliomas of the adult: results of a randomised phase III trial on dose response (EORTC trial 22844). EORTC Radiotherapy Co-operative Group. Eur J Cancer. 1998;34:1902-9.
26. Hauswald H, Rieken S, Ecker S, et al. First experiences in treatment of low-grade glioma grade I and II with proton therapy. Radiat Oncol. 2012;7:189.
27. Shih HA, Sherman JC, Nachtigall LB, et al. Proton therapy for low-grade gliomas: results from a prospective trial. Cancer. 2015;121:1712-9.
28. Particle Therapy Co-Operative Group. Particle therapy centers. https://www.ptcog.ch. Accessed August 4, 2017.
29. Verma V, Shah C, Rwigema JC, et al. Cost-comparativeness of proton versus photon therapy. Chin Clin Oncol. 2016;5:56.
30. Verma V, Mishra MV, Mehta MP. A systematic review of the cost and cost-effectiveness studies of proton radiotherapy. Cancer. 2016; 122:1483-501.
31. Buckner JC, Shaw EG, Pugh SL, et al. Radiation plus procarbazine, CCNU, and vincristine in low-grade glioma. N Engl J Med. 2016; 374:1344-55.
32. Jaeckle K, Vogelbaum M, Ballman K, et al. CODEL (Alliance-N0577; EORTC-26081/22086; NRG-1071; NCIC-CEC-2): phase III randomized study of RT vs. RT+TMZ vs. TMZ for newly diagnosed 1p/19q-codeleted anaplastic oligodendroglial tumors. Analysis of patients treated on the original protocol design. Neurology. 2016;86(suppl 16):abstr PL02.005.
