医脉通编译,转载请务必注明出处
Science杂志于4月3日发布了“癌症免疫学与免疫治疗”专题,推出了回顾肿瘤免疫治疗各方面进展的系列文章。医脉通整理“免疫检测点治疗的未来”篇章中关于部分抗-CTLA-4和抗-PD-1/PD-L1两种疗法的内容,详情如下:
相关资讯》》》“兑现承诺”,Science发布癌症免疫治疗专题
以病理组织为基础的免疫监测:抗-CTLA-4疗法
在术前或以病理组织为基础的临床试验中,病人是在手术切除肿瘤前接受药物治疗。这类试验如果设计得好,可以通过对大量的组织进行一系列的分析使得研究者更加了解免疫检查点疗法的细胞和分子机制。对肿瘤组织的数据分析可以指导外周血中相关指标的研究。我们进行了抗-CTLA-4(ipilimumab)的首次术前临床试验,在12例诊断为局限性膀胱癌的病人进行全膀胱切除术前给予了药物。试验的终点是安全性和是否有组织可进行免疫监测。我们并不把这个试验看作是用于观察术前给药临床获益的新辅助治疗方面的研究。我们认为它是一项有关抗-CTLA-4疗法对于肿瘤微环境影响的机制的术前研究。
以病理组织为基础的免疫监测:抗-PD-1/PD-L1疗法
由于免疫检查点疗法仅能对一部分病人有效,科学家还在努力寻找一些预测指标用于相关疗法的适用病人筛选。由于PD-1的配体PD-L1(有时是PD-L2)可以表达在肿瘤微环境中的肿瘤细胞和免疫细胞上,有研究者尝试使用PDL1的表达量作为病人是否可以用针对PD-1/PD-L1通路的抗体。
抗-PD-1疗法(nivolumab)的I期临床试验初期结果显示,使用免疫组织化学(IHC)方法检测出的治疗前样本中肿瘤细胞的PD-L1表达量可能可预测患者是否能从该治疗中获益。PD-L1阳性的肿瘤患者(肿瘤细胞PD-L1染色≥5%)的客观缓解率是36%(25例中的9例),而17例PD-L1阴性的患者均无临床缓解。然而,在后续的试验中,一些PD-L1阴性的患者也对抗-PD-1和抗-PD-L1治疗有反应,且与肿瘤是否进展无关。例如,在抗-PD-1(nivolumab)的I期临床试验中,PD-L1阳性的患者客观缓解率为44%(16例中7例),而PD-L1阴性的患者客观缓解率为17%(18例中3例)。尽管PD-L1在肿瘤组织中的表达量与缓解率正相关,这个表达量却不能预测患者的临床获益。目前的数据也显示缓解率的差异并不能等价于生存率上的差异。一项予以转移性黑色素瘤患者nivolumab治疗的III期临床试验中,患者的中位总生存时间并未达到PD-L1试验中任一亚组的水平,且与接受达卡巴嗪化疗的患者相比,两个亚组的总生存时间均有显著提高。在一项抗-PD-L1(MPDL3280A)的I期临床试验中,如果膀胱癌患者的治疗前肿瘤组织中含有超过5%的PD-L1阳性的肿瘤浸润的免疫细胞,这名患者就被认定为患有PD-L1阳性的肿瘤。该试验先入组了21例PD-L1阳性的患者后,又入组了21例PD-L1阴性的患者。在经过至少6周的随诊后研究者报道了结果。PD-L1阳性患者的客观缓解率为43.3%(30例13例),疾病稳定率为26.7%(30例中8例),而PD-L1阴性患者的客观缓解率和疾病稳定率分别为11.4%(35例中4例)和37.1%(35例中13例)。由于PD-L1阳性的患者接受治疗的时间更长,因此无法明确结果的差异是PD-L1表达的不同还是治疗时间的不同造成的。然而,对于那些在一线化疗后疾病仍进展且无公认的二线治疗方案的转移性膀胱癌患者来说,11%的客观缓解率和37.1%的疾病稳定率已经有很大的临床意义了。
同样,在另一项抗-PD-L1(MPDL3280A)用于多种肿瘤治疗的I期临床试验中PD-L1高表达的患者的客观缓解率为46%,高表达的患者为17%,低表达的患者为21%,无表达的患者为13%。所以,这项实验表明即使PD-L1阴性患者在抗-PD-L1治疗后也有客观缓解的可能。有趣的是,PD-L1中表达的患者的客观缓解率(17%)和中位无病生存时间(18周)与PD-L1低表达的患者相似(分别为21%和17周),而低表达者的PD-L1表达状态更靠近无表达者。因此需要更多的研究来证实PD-L1在肿瘤微环境中的表达状态是否影响使用抗-PD-L1治疗的患者的预后。
基于目前的试验结果,似乎可以认为PD-L1在肿瘤组织中的表达无法用于预测患者是否能够使用抗-PD-1或抗-PD-L1进行治疗。在一项针对原发性和转移性黑素瘤样本的研究中,原发性肿瘤和转移性肿瘤组织的PD-L1表达并不一致,在不同患者的转移性肿瘤组织中PD-L1的表达也不一致。此外,那些肿瘤组织中同时有PD-L1表达和T细胞浸润的患者的总疾病特异性生存时间要长于只有其中一项或两项都没有的患者。
同样,一项关于抗-PD-1(pembrolizumab)的研究报道了尽管治疗前肿瘤组织中的PD-1与临床预后相关,肿瘤浸润边缘的CD8 T细胞的数量对患者使用抗-PD-1的治疗反应的预测性更好。这意味着PD-L1在肿瘤组织中的表达的预测作用在有激活的T细胞反应的情况下更可信,也说明持续进行的T细胞反应本身才是关键因素。
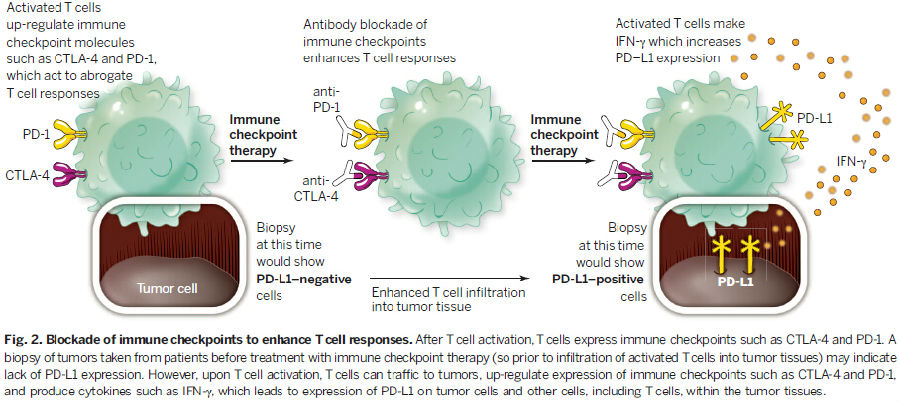
总之,上述数据说明了通过检测单一术前肿瘤组织来明确患者肿瘤中PD-L1的状态是不可靠的(图 2)。同时这些研究也带来了一些问题,如对于那些传统治疗失败和没有其他治疗选择的患者,临床医生是否应该根据对治疗前肿瘤组织中PD-L1表达的静态估计来进行临床决策。
点击看大图
然而,在一些情况下,PD-L1在肿瘤中的表达是固定的,与T细胞浸润无关,也不受IFN-γ的诱导。对于这种情况,评估PD-L1在肿瘤组织中的表达可能可以指导治疗。在霍奇金淋巴瘤中,Reed-Sternberg细胞可以保护(harbor)编码PD-L1和PD-L2的染色体9p24.1的扩增,导致它们的持续表达。有研究报道了抗- PD-1(nivolumab)在20例霍奇金淋巴瘤患者中可以达到87%的客观缓解。因此,在霍奇金淋巴瘤中,PD-L1和PD-L2这些配体可能能够成为一个预测疗效的指标。这个结论可能也适用于其他一些可以保护染色体9p24的扩增或上调PD-L1或PD-L2表达的恶性肿瘤。
除了评估PD-L1的表达,肿瘤组织还可用于研究多种免疫学成分的表达方式,包括其他免疫检查点和他们的配体。同时表达PD-1和其他一些抑制性分子(如LAG-3或Tim-3)的T细胞可能要比仅表达PD-1的T细胞反应差,这也说明了抑制多个检查的必要性。考虑到T细胞反应是由多个有上调或下调作用的信号通路来调节的,我们有必要去明确肿瘤微环境中T细胞、肿瘤细胞、髓细胞及其他成分中这些受体和配体的表达,以期获得有更好治疗效果的联合治疗策略。
通过对肿瘤细胞进行基因分析可能也是一种发现其他在抗肿瘤效应中起作用的指标的方法。更多的突变(包括DNA修复通路的突变以及其导致的肿瘤抗原的增多)被认为与接受抗-PD-1(pembrolizumab)治疗的非小细胞肺癌患者的治疗反应相关,与之前关于抗-PD-1的报道类似。这些数据更加说明了肿瘤细胞和免疫系统的相互作用的复杂性。我们需要对此进行更深入的研究来更好地指导联合治疗方案的开发。
医脉通编译自:The future of immune checkpoint therapy,Science,April 6,2015
