2015年6月26-28日,第十届全国胃癌学术会议暨第三届阳光长城肿瘤学术会议在北京召开,本次大会由中国抗癌协会胃癌专业委员会、北京大学肿瘤医院主办。27日下午的内科专场上,来自中国医科大学附属第一医院肿瘤内科的刘云鹏教授做了题为《靶向药物时代下化学药物的瓶颈与发展》的报告,医脉通整理如下:

晚期胃癌的化疗发展史
肿瘤的药物治疗是从化疗开始,胃癌同其他癌症一样,也经历了最佳支持治疗(1960s,开始探索晚期胃癌治疗),单药治疗(1990s,化疗优于最佳支持治疗),两药联合(2000s,两药氟尿嘧啶+铂类优于单药),三药联合(2006,氟尿嘧啶+铂类+蒽环/氟尿嘧啶+铂类+紫杉,存在高效,高毒的问题),一直到现在靶向治疗时代(2010年后,个体化治疗里程碑,氟尿嘧啶+铂类+靶向)的来临。
在当前以精准医疗,靶向治疗为热门话题的时代,化疗不再给大家带来那么浓厚的兴趣。但是,我们思考一下,有多少患者适合靶向药物,尤其胃癌,这一异质性高的癌症,即使是ToGA研究也表明只有10%左右的胃癌患者会从靶向药物获益。从下图中可以看出,很多化疗方案都优于最佳支持治疗,而存在的问题是这些化疗药物带给晚期胃癌患者的中位OS均未超过12个月。
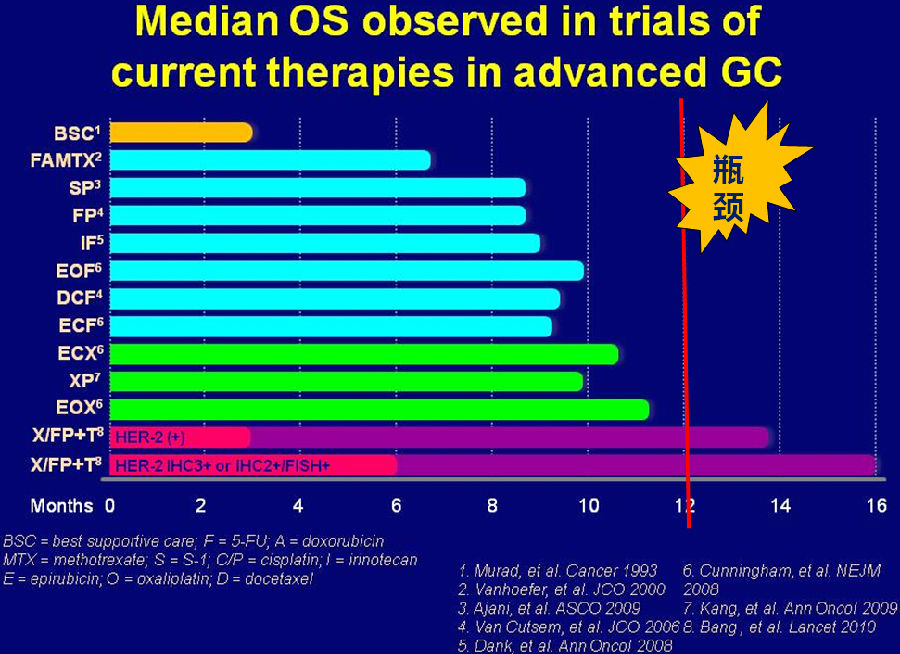
目前,晚期胃癌治疗常用的药物有铂类,氟尿嘧啶类,蒽环类,紫杉类,伊立替康,和靶向药物(曲妥珠单抗,阿帕替尼)。当前靶向药物有限,HER-2阳性胃癌只占10-20%,多数病人只能接受化疗。目前化疗药物中,氟尿嘧啶和铂类仍是基石。如何优化和组合这些药物,是我们面临的问题。NCCN指南胃癌(2015.V3)推荐首选两药联合(氟尿嘧啶+铂类/氟尿嘧啶+伊立替康),对于高选择的病人可以选择三药联合。
晚期胃癌化疗现状
我们所看到的治疗推荐级别是研究设计级别,研究设计的级别高得到的证据级别也高。因此,氟尿嘧啶+铂类仍是基石(1类证据)。今年更新了FOLFIRI方案作为1类证据推荐,但该临床研究是以ECX为对照组,首要终点为TTF,虽然首要终点达到了优效性检验的统计学差异,但是,次要终点PFS和OS两组无差异,因此作为一线用药时仍存在疑虑。所以,当前一线化疗相关研究主要围绕:哪种氟尿嘧啶更优(5-FU or 卡培他滨 or S-1)?哪种铂类更优(顺铂 or 奥沙利铂)?在一线治疗中,紫杉和伊立替康是否可以替代FU或铂类?
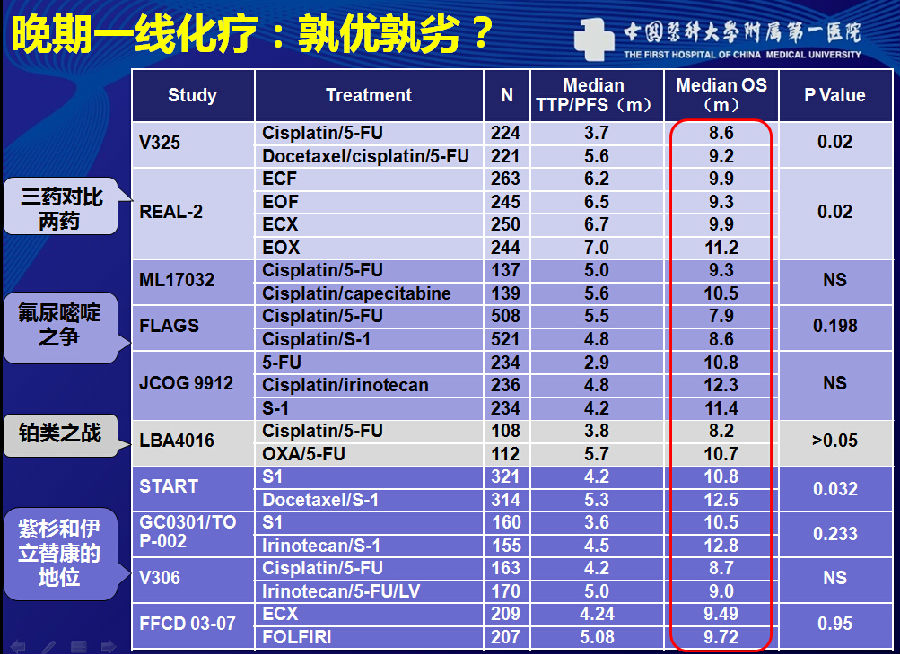
晚期一线化疗,哪种方案更优?从下图可以看出,回顾众多一线化疗的临床研究,无论三药还是两药,OS未见显著性提高,这提示在化疗方案的组合方面难以有突破性进展。
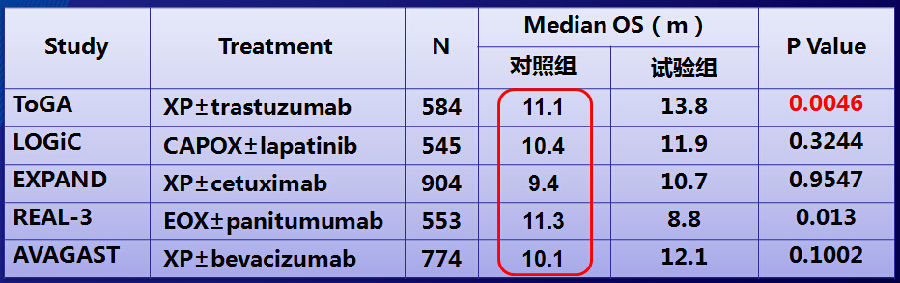
化疗+靶向治疗作为晚期一线治疗情况如何?从下表可以看出,与靶向药物联合时,XP和CAPOX方案多为较弱的两药方案,但是中位OS仍能达到10个月左右;而REAL-3研究的结果提示我们,加大化疗强度不能进一步增加靶向药的药疗,反而出现相反的结果。
综上所述,我们现在所面临的问题是,两药方案的效果似乎与三药联合差不多,没有绝对优势的两药方案。现在开展化疗药物研究的意义是什么?是降低患者的毒副反应?还是为了新的化疗药物上市?随着靶向药物时代的到来,大家对化疗药物的兴趣越来越低,化疗药物带来大家的治疗效果也未达到预期,化疗药物的这些瓶颈该如何突破?
化疗药物的瓶颈如何突破?——个体化药物选择
生物标志物(biomarker)

化疗药物受药代动力学,各种酶,以及相互作用点的影响,其实也有能识别的生物标志物。那么我们能不能通过化疗药物的这些标志物,选择合适的患者给予治疗?文献数据告诉我们,这些研究多为回顾性研究,异质性强,结论不一致,而且尚未在大型RCT研究中验证。两项证明肺癌中关于ERCC1对铂类药物敏感性的验证研究,其结果也为阴性。因此,单一生物标志物是很难预测化疗药物的疗效。
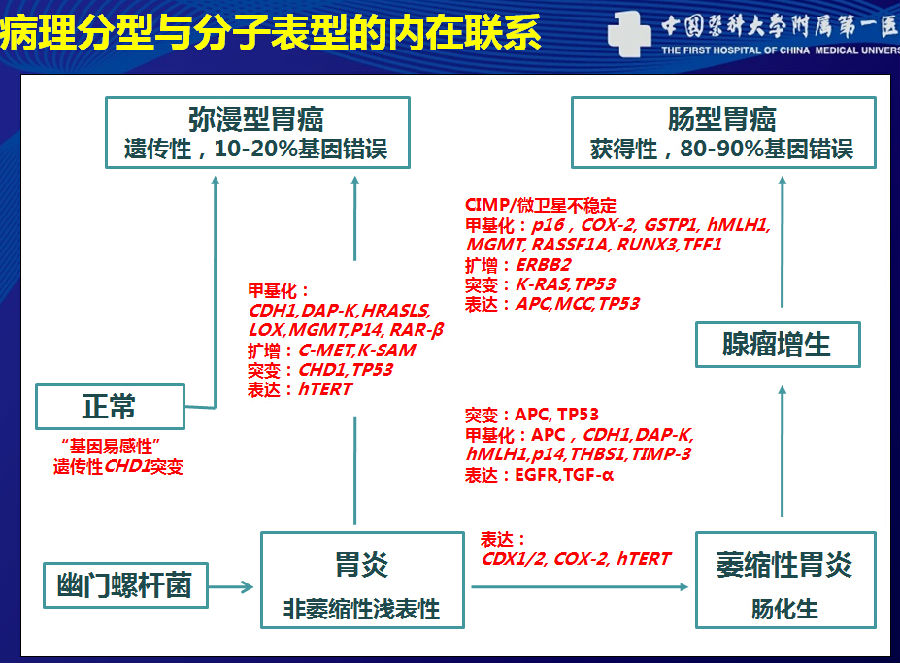
病理分型
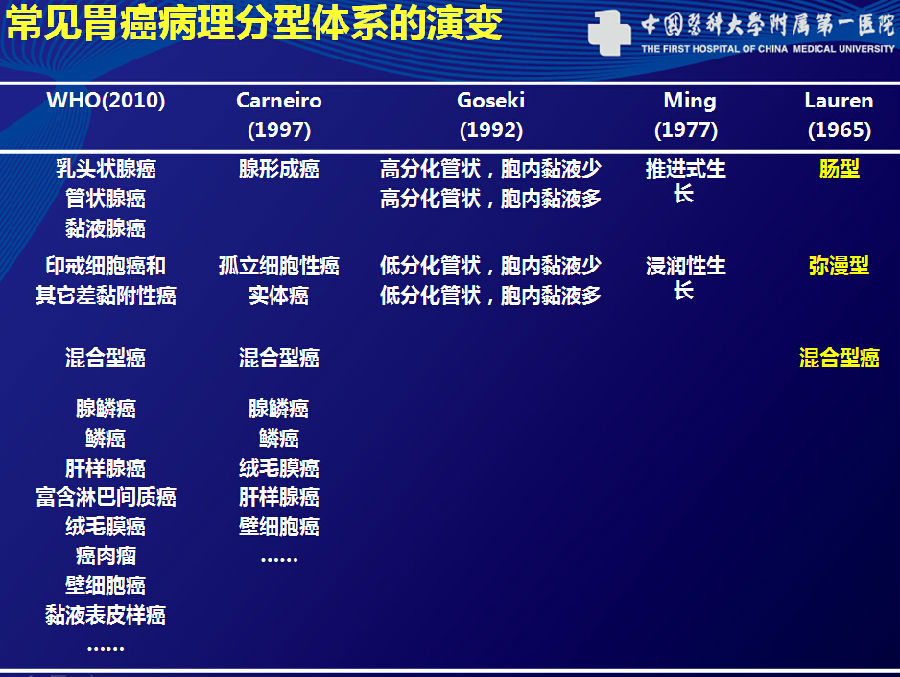
胃癌的异质性很高,按照已有的病理分型(上图所示,WHO分型)只表能明胃癌来自于哪个细胞,对于哪种药物敏感目前仍不清楚。而Lauren分型反能为我们判断预后提供了比较好的指导。

然而,不同Lauren分型对化疗反应可能不同的结果是在细胞系水平进行的,对于一个胃癌患者应用氟尿嘧啶来讲,他对药物的敏感性除了受TS及DPD影响外,药物本身在体内的药代也影响着药效。以氟尿嘧啶为例,S-1含有DPD酶的抑制剂,而弥漫型胃癌中DPD酶水平高,理论上似乎S-1对弥漫型胃癌效果要好于其他FU。然而,FLAGS研究FAS集显示CS于CF未见显著性差异,进行亚组分型后发现弥漫型亚组中,CS(OS:9.0个月)优于CF(OS:7.1个月)。所以,基于Lauren分型的前瞻性研究,设计了DIGEST试验(在未经治疗的转移性弥漫型胃腺癌中:S-1+顺铂 vs 5-FU+顺铂的III期研究),一共有690例晚期初治胃癌患者入组,结果显示CS(OS:7.5个月)与CF(OS:6.6个月)无显著差异,这提示单一的Lauren分型不足以预测化疗药的敏感性。
分子分型
大量的数据显示,在所有恶性肿瘤中,胃癌属于具有基因突变和扩增数量较高的瘤种。所以,目前由很多从基因水平(突变,拷贝数变化,表达谱,甲基化),RNA水平(microRNA),蛋白水平等技术,对胃癌进行分子分型。
2011年,通过对37个胃癌细胞系和521例肿瘤标本进行测序,将胃癌分成两种内在亚型:基因肠型(G-INF)和基因弥漫型(G-DIF)。研究显示这种分子分型有预后价值:基因肠型的生存优于基因弥漫型。2013年另一种胃癌分子分型方法,将胃癌分成间充质型,增殖型,和代谢型,这种分型可预测术后患者接受5-FU辅助化疗的疗效。增殖型不能从5-FU辅助化疗中获益,代谢型可获益,而间充质型不确定。但是这项研究中纳入的患者人数较少(间充质型和代谢型患者仅有28例),是否能适用于临床不予评价。2014年,《Natute》上一项研究根据胃癌综合分子特征将胃癌分成EB病毒阳性型,微卫星不稳定型,基因稳定型,染色体不稳定型四种。
单独的病理分型,分子分型用于指导胃癌预后效果并不尽如人意。所以,病理分型与分子分型并不是相互独立的,存在内在联系。如Lauren分型的肠型和弥漫型分别伴有各自的分子事件。未来,将病理分型与分子分型相结合,可能会更好的区分不同的亚型,以指导预后和预测药物疗效。
小结与展望
靶向药物治疗时代已经来临,而绝大数患者治疗仍将以化疗为主。在治疗过程中,单一的生物标志物或病理分型均不足以预测化疗药的疗效。结合组织学分型和分子分型,可能会更好的预测预后和化疗药的疗效,但仍需在更大的样本中进行验证。未来,药物基因组学和药代动力学将为提高疗效,降低副作用提供依据。因此,药物优化,特别是序贯治疗和维持治疗仍是今后值得探索的选择。
大会专题>>>第十届全国胃癌学术会议暨第三届阳光长城肿瘤学术会议
