医脉通编译,转载请务必注明出处
导读:抗血管生成和抗表皮生长因子受体(EGFR)药物在结直肠癌的姑息治疗、辅助治疗和新辅助治疗中的地位已进行广泛研究。虽然这些生物制剂在转移性结直肠癌(mCRC)一线、二线和三线治疗中的作用已经明确,但对于最佳用药顺序和患者适应症选择的争议一直存在。多项III期临床研究评估了将贝伐珠单抗或西妥昔单抗纳入辅助治疗方案以治疗II/III期癌症的获益,结果令人失望。对于肝转移患者,将生物治疗纳入新辅助治疗,治疗结果不一。虽然目前证据提示对于初始不可切除或临界可切除肝转移患者来说,加用西妥昔单抗可以增加降期和可切除的机会,但其对于延长总生存期的作用并不确定。而对于可切除肝转移患者来说,在新辅助化疗方案基础上联用西妥昔单抗,不仅无额外获益,且可能有潜在危害。同样的,对于这类患者,尚无理论依据或试验数据支持将贝伐单抗纳入新辅助治疗。在本综述中,作者详细回顾了抗血管生成药物和抗EGFR药物在辅助治疗、新辅助治疗和转移性疾病中的作用。医脉通整理如下:
在过去10年,mCRC的治疗取得巨大进步,其患者中位生存期不低于30月[1,2]。这一进步一部分可以归功于在转移性疾病的主流治疗中纳入生物治疗,不论是抗血管生成治疗还是抗EGFR治疗。虽然生物治疗对治疗进展期不可切除的患者取得成就,但其在辅助治疗和新辅助治疗中的作用不那么令人满意。
生物治疗在结直肠癌辅助治疗中的作用
贝伐珠单抗治疗II期和III期结肠癌
多项III期临床试验对贝伐珠单抗与系统性化疗联用辅助治疗结直肠癌进行了研究。NSABP C-08临床试验入组了2710名II期或III期的结肠癌患者,这些患者被随机分组,接受6月(12次)改良FOLFOX6方案化疗,分别联合或不联合1年的贝伐单抗治疗[3,4]。结果显示,在研究对象总体和II期或III期患者亚群中,两组间无疾病生存期或总生存期均无差别。有趣的是,贝伐珠单抗对于无疾病生存期的影响在15个月时发生了转折。治疗初始15月内贝伐珠单抗组相对对照组的复发风险比为0.61(95% CI,0.48-0.78)。但15个月之后,这一情况发生了改变,贝伐珠单抗组复发率开始呈上升趋势。对该试验人群基于错配状态的事后分析显示,在错配缺陷的队列,使用贝伐珠单抗获益(HR 0.52;95% CI,0.29-0.94)[5]。
AVANT III期临床试验中,II期或III期结肠癌患者接受6个月的奥沙利铂/氟尿嘧啶化疗联合或不联合贝伐珠单抗[6]。患者按照1:1:1的比例随机分配至3个治疗组,分别是:FOLFOX4,FOLFOX4联合1年贝伐珠单抗,XELOX联合1年贝伐珠单抗。结果显示化疗联合贝伐珠单抗未延长无疾病生存期。与FOLFOX4组相比,贝伐珠单抗/FOLFOX4组和贝伐珠单抗/XELOX组无疾病生存期的风险比分别为1.17(95% CI,0.98-1.39)和1.07(95% CI,0.9-1.28)。与NSABP-C08研究类似,早期随访显示贝伐珠单抗可延长无疾病生存期。在第一年,与FOLFOX4组相比,贝伐珠单抗/FOLFOX4组和贝伐珠单抗/XELOX组无疾病生存期的风险比分别为0.63和0.61。但在第2、3年,这一作用被贝伐珠单抗的不利作用抵消了。总的趋势是贝伐珠单抗组复发率增加。复发率的反弹性增加也进一步导致与FOLFOX4组相比,贝伐珠单抗/FOLFOX4组和贝伐珠单抗/XELOX组均表现出对总生存期的不利作用。最后,QUASAR2研究将1941名III期或高危II期的结直肠癌患者随机分组,接受8次卡培他滨化疗(24周),联合或不联合16次间隔为3周的贝伐珠单抗治疗(共48周)[7]。前2年随访发现贝伐珠单抗组无疾病生存期有延长趋势,但2年以后的随访发现贝伐珠单抗组复发率增加,最终贝伐珠单抗组和对照组相比,无疾病生存期的风险比为1.6。研究进一步对微卫星稳定组和微卫星不稳定组进行亚组分析,结果显示微卫星稳定组贝伐珠单抗对无疾病生存期产生不利影响(HR 1.43,P=0.0005),而在微卫星不稳定组贝伐珠单抗对结局无影响(HR 0.74,P=0.42)。
对于II期或III期患者,细胞毒性药物辅助化疗基础上加用贝伐珠单抗无额外获益。相反的,加用贝伐珠单抗可能导致治疗完成时复发率增加,进一步影响总生存期,这一发现也令人担忧。有人提出假说以解释为什么微卫星不稳定组贝伐珠单抗对结局无影响,但未来仍需要在该人群中进一步探究。
西妥昔单抗在结直肠癌辅助治疗的作用
N0147和PETACC-8临床试验探究了抗EGFR治疗在辅助治疗中的作用[8,9]。N0147最初的实验设计是将III期结肠癌患者随机分配,接受6个月的FOLFOX 、FOLFIRI或者FOLFOX/FOLFIRI序贯治疗,同时联合或不联合西妥昔单抗。后来方案进行了修改,FOLFIRI组和序贯FOLFOX/FOLFIRI组停止招募,并将研究入组条件限制到KRAS-野生型肿瘤[8]。研究一共招募了2070名KRAS野生型肿瘤患者。结果显示在KRAS野生型(HR 1.21;95% CI,0.98-1.49)或KRAS/BRAF人群中,加用西妥昔单抗组与单纯FOLFOX组相比,3年无疾病生存率无明显获益。进一步亚组分析也未发现使用西妥昔单抗存在生存获益。值得注意的是,由于样本量小,尚不能得出确切结论。但是探索性数据分析显示西妥昔单抗/FOLFIRI组与单纯FOLFIRI组相比,无疾病生存期和总生存期延长[10]。PETACC-8临床研究将III期结肠癌患者随机分组,接受6个月的FOLFOX4方案化疗,联合或不联合西妥昔单抗[9]。与N0147研究类似,该研究方案最终改为只纳入KRAS-野生型肿瘤患者。结果显示在KRAS野生型肿瘤患者(HR 1.05;95% CI,0.85-1.29;P=0.66)和KRAS/BRAF野生型肿瘤患者(HR 0.99;95% CI,0.76-1.28;P=0.92)中,西妥昔单抗在无疾病生存期上均无获益。有趣的是,在亚组分析中,T4N2期肿瘤患者加用西妥昔单抗获益明显,而女性患者和右侧结肠癌的患者单纯化疗组无疾病生存期明显延长。
因此,基于N0147与PETACC-8这两项研究,尚不支持将西妥昔单抗纳入结肠癌辅助治疗。尽管PETACC-8研究的亚组分析提示对于进展期T4N2的患者来说,使用西妥昔单抗可能存在获益,但这仅处在假说阶段。很显然,研究者需要一个比RAS和BRAF预测意义更强的反应标志物来重新探究抗EGFR治疗在mCRC辅助治疗中的作用。至于为什么抗EGFR治疗在辅助治疗中的作用与其在转移性疾病研究中的结果不一致,原因尚不清楚,可能是由于在转移性情况下,尽管治疗达到降期,但并未成功诱导完全病理性灭瘤。
生物治疗在转移性结直肠癌新辅助治疗中的作用
生物治疗在可切除转移性结直肠癌新辅助治疗中的作用
当考虑新辅助治疗在转移性结直肠癌治疗中的作用,首先需要明确治疗目标。新辅助治疗的适应症包括:(1)降低可切除肝转移患者的疾病复发率(2)对于潜在可切除转移癌患者降期。EORTC40983研究将患者随机分配,分别接受围手术期FOLFOX化疗或观察[11]。研究显示FOLFOX化疗可提高研究主要终点——3年无疾病生存率,但未证实其可延长总生存期[11,12]。由于EORTC研究中对照组未进行术后化疗,因此围手术期化疗与辅助术后化疗的获益比较目前未得到证实。
目前认为将贝伐珠单抗与新辅助化疗方案CAPOX,FOLFOX,FOLFIRI,和FOLFOXIRI等联用以治疗可切除肝转移癌患者是可行的[13-15]。回顾性研究提示将贝伐珠单抗纳入肝转移结直肠癌术前化疗,可提高肝转移灶完全病理性缓解率,降低肝窦损害发生率[16-18]。但是缺少强力的证据表明其可以延长无疾病生存期或总生存期。鉴于贝伐珠单抗在III期结直肠癌患者研究中结果令人失望,没有充分理由将其纳入可切除转移性结直肠癌患者新辅助治疗或术后治疗中。事实上,最近一项回顾性分析显示,接受肝切除联合辅助化疗的患者,接受贝伐珠单抗并无额外获益[19]。
新EPOC研究探究了西妥昔单抗在可切除肝转移结直肠癌新辅助治疗中的地位[20]。在这项III期临床研究中,可切除或亚可切除肝转移KRAS野生型转移性结直肠癌患者被随机分配,接受围手术期化疗,联合或不联合西妥昔单抗。结果显示化疗/西妥昔单抗组与单纯化疗组相比,无进展生存期明显缩短(14.1 vs 20.5个月;HR 1.48;95% CI,1.04-2.12;P=0.03)。化疗方案主要是奥沙利铂为基础的方案(FOLFOX或XELOX),但11%的患者接受了FOLFIRI。由于接受伊立替康的患者少,因此该亚组无法得出明确结论[20]。但这一研究因其缺少充分的手术质量控制、患者一般特征组间不均衡、化疗方案不一致以及不明原因的早期死亡率升高而饱受谴责[21]。
新EPOC研究中西妥昔单抗的不利作用以及III期患者接受辅助西妥昔单抗治疗无获益提示对KRAS野生型肿瘤加用西妥昔单抗无法提高微观肿瘤根除率,也不降低疾病复发风险。因此,需避免在可切除肝转移患者中使用西妥昔单抗。
生物治疗在潜在可切除转移性结直肠癌治疗的作用
对于就诊时不可切除但临床缓解后可能可切除的转移性肿瘤,先降低分期再切除被认为是标准治疗方法。经过化疗降低分期后可切除的患者5年生存率达到30%-50%,远超过姑息化疗患者5年生存率[22,23]。因此,将最有效的化疗组合用于治疗进展期、潜在可切除的转移性结直肠癌是非常必要的。
由于尚无随机试验对比此情况下细胞毒性化疗方案与细胞毒性化疗/贝伐珠单抗的疗效,因此无法确定抗血管生成因子在降低分期后切除中的作用。但是,由于许多潜在可切除患者并不能够手术切除,且贝珠伐单抗可延长无疾病生存期和总生存期,因此此情况下常规应用贝伐珠单抗可以接受,尤其是不考虑或不建议使用抗EGFR药物时。加用贝伐珠单抗的其他考虑来自于回顾性分析。这些分析显示化疗基础上加用贝伐珠单抗可提高完全性病理缓解率,降低肝窦损伤[16-18]。当考虑使用贝伐珠单抗治疗潜在可切除的转移性结直肠癌,需考虑最有效的化疗方案。为达到这一目的,OLIVIA临床研究将最初无法切除的肝转移患者随机分配,接受FOLFOX/贝伐珠单抗或FOLFOXIRI/贝伐珠单抗治疗[15]。结果显示FOLFOXIRI组反应率高、切除率高、完全切除率高、无进展生存期长(表1)。
尽管对于可切除肝转移结直肠癌患者来说,在化疗基础上加用西妥昔单抗的疗效令人失望,但其对于不可切除—潜在可切除肝转移结直肠癌患者的价值得到了多项研究证实。一项III期临床研究将不可切除肝转移KRAS-野生型肿瘤患者随机分配,分别接受一线FOLFOX治疗或FOLFOX/西妥昔单抗治疗[24]。加用西妥昔单抗患者反应率高、肝完全切除率高、总生存率高(表1)。其他几项II期试验也支持加用西妥昔单抗。这些试验同样显示该治疗方案缓解率和切除率高[25,26]。此外,CALGB 80405最新更新数据显示1137名KRAS野生型肿瘤患者中15.7%接受了手术切除[27]。这些患者入组后以1:1的比例随机分组,分别接受化疗联合贝伐珠单抗或化疗联合西妥昔单抗治疗。 结果显示西妥昔单抗组切除率高(无疾病征象)(62% vs 38%),但两组间切除后生存期无差异,提示术前使用西妥昔单抗与贝伐珠单抗相比,对术后结果未产生不利影响(表1)。
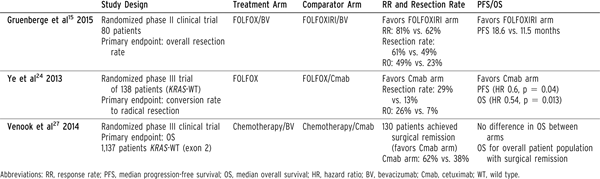
在不可切除-潜在可切除的转移性结直肠癌患者中,使用贝伐珠单抗和西妥昔单抗都是合理的。鉴于大多数患者最终不能切除,将生物治疗纳入一线治疗主要是考虑其对改善无疾病生存期和总生存期的作用。对于RAS-突变型或BRAF突变型肿瘤,对于年轻体能状态好的患者更推荐使用FOLFOXIRI/贝伐珠单抗方案。而对于体能状态不佳、年老患者,双重化疗药物选择时,对RAS野生型肿瘤来说,因为抗EGFR药比贝伐单抗降期效果更明显,因此加用抗EGFR药可能更合理。
参考文献:
[1]Loupakis F, Cremolini C, Masi G, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer. N Engl J Med. 2014;371:1609-1618.
[2]Venook A, Niedzwiecki D, Lenz H-J, et al. CALGB/SWOG 80405: phase III trial of irinotecan/5-FU/leucovorin (FOLFIRI) or oxaliplatin/5-FU/leucovorin (mFOLFOX6) with bevacizumab (BV) or cetuximab (CET) for patients (pts) with KRAS wild-type (wt) untreated metastatic adenocarcinoma of the colon or rectum (MCRC). J Clin Oncol. 2014;32:5s (suppl; abst LBA4).
[3]Allegra CJ, Yothers G, O'Connell MJ, et al. Phase III trial assessing bevacizumab in stages II and III carcinoma of the colon: results of NSABP protocol C-08. J Clin Oncol. 2011;29:11-16.
[4]Allegra CJ, Yothers G, O'Connell MJ, et al. Bevacizumab in stage II-III colon cancer: 5-year update of the National Surgical Adjuvant Breast and Bowel Project C-08 trial. J Clin Oncol. 2013;31: 359-364.
[5]Pogue-Geile K, Yothers G, Taniyama Y, et al. Defective mismatch repair and benefit from bevacizumab for colon cancer: findings from NSABP C-08. J Natl Cancer Inst. 2013;105:989-992.
[6]de Gramont A, Van Cutsem E, Schmoll HJ, et al. Bevacizumab plus oxaliplatin-based chemotherapy as adjuvant treatment for colon cancer (AVANT): a phase 3 randomised controlled trial. Lancet Oncol. 2012;13:1225-1233.
[7]Midgley R, Love S, Tomlinson I, et al. Final results from QUASAR2, a multicentre, international randomised phase III trial of capecitabine (CAP) +/- bevacizumab (BEV) in the adjuvant setting of stage II/III colorectal cancer (CRC). Paper presented at: ESMO 2014 Congress; September 2014; Madrid, Spain.
[8]Alberts SR, Sargent DJ, Nair S, et al. Effect of oxaliplatin, fluorouracil, and leucovorin with or without cetuximab on survival among patients with resected stage III colon cancer: a randomized trial. JAMA. 2012;307:1383-1393.
[9]Taieb J, Tabernero J, Mini E, et al. Oxaliplatin, fluorouracil, and leucovorin with or without cetuximab in patients with resected stage III colon cancer (PETACC-8): an open-label, randomised phase 3 trial. Lancet Oncol. 2014;15:862-873.
[10]Huang J, Nair SG, Mahoney MR, et al. Comparison of FOLFIRI with or without cetuximab in patients with resected stage III colon cancer; NCCTG (Alliance) intergroup trial N0147. Clin Colorectal Cancer. 2014;13:100-109.
[11]Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative chemotherapy with FOLFOX4 and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC Intergroup trial 40983): a randomised controlled trial. Lancet. 2008;371:1007-1016.
[12]Nordlinger B, Sorbye H, Glimelius B, et al. Perioperative FOLFOX4 chemotherapy and surgery versus surgery alone for resectable liver metastases from colorectal cancer (EORTC 40983): long-term results of a randomised, controlled, phase 3 trial. Lancet Oncol. 2013;14:1208-1215.
[13]Nasti G, Piccirillo MC, Izzo F, et al. Neoadjuvant FOLFIRI+bevacizumab in patients with resectable liver metastases from colorectal cancer: a phase 2 trial. Br J Cancer. 2013;108:1566-1570.
[14]Gruenberger B, Tamandl D, Schueller J, et al. Bevacizumab, capecitabine, and oxaliplatin as neoadjuvant therapy for patients with potentially curable metastatic colorectal cancer. J Clin Oncol. 2008;26:1830-1835.
[15]Gruenberger T, Bridgewater J, Chau I, et al. Bevacizumab plus mFOLFOX-6 or FOLFOXIRI in patients with initially unresectable liver metastases from colorectal cancer: the OLIVIA multinational randomised phase II trial. Ann Oncol. Epub 2014 Dec 23.
[16]Ribero D, Wang H, Donadon M, et al. Bevacizumab improves pathologic response and protects against hepatic injury in patients treated with oxaliplatin-based chemotherapy for colorectal liver metastases. Cancer. 2007;110:2761-2767.
[17]Gruenberger T, Arnold D, Rubbia-Brandt L. Pathologic response to bevacizumab-containing chemotherapy in patients with colorectal liver metastases and its correlation with survival. Surg Oncol. 2012;21:309-315.
[18]Klinger M, Eipeldauer S, Hacker S, et al. Bevacizumab protects against sinusoidal obstruction syndrome and does not increase response rate in neoadjuvant XELOX/FOLFOX therapy of colorectal cancer liver metastases. Eur J Surg Oncol. 2009;35:515-520.
[19]Turan N, Benekli M, Koca D, et al. Adjuvant systemic chemotherapy with or without bevacizumab in patients with resected liver metastases from colorectal cancer. Oncology. 2013;84:14-21.
[20]Primrose J, Falk S, Finch-Jones M, et al. Systemic chemotherapy with or without cetuximab in patients with resectable colorectal liver metastasis: the New EPOC randomised controlled trial. Lancet Oncol. 2014;15:601-611.
[21]Nordlinger B, Poston GJ, Goldberg RM. Should the Results of the New EPOC Trial Change Practice in the Management of Patients With Resectable Metastatic Colorectal Cancer Confined to the Liver? J Clin Oncol. 2015;33:241-243.
[22]Adam R, Avisar E, Ariche A, et al. Five-year survival following hepatic resection after neoadjuvant therapy for nonresectable colorectal. Ann Surg Oncol. 2001;8:347-353.
[23]Adam R, Delvart V, Pascal G, et al. Rescue surgery for unresectable colorectal liver metastases downstaged by chemotherapy: a model to predict long-term survival. Ann Surg. 2004;240:644-657; discussion 657-658.
[24]Ye LC, Liu TS, Ren L, et al. Randomized controlled trial of cetuximab plus chemotherapy for patients with KRAS wild-type unresectable colorectal liver-limited metastases. J Clin Oncol. 2013;31:1931-1938.
[25]Garufi C, Torsello A, Tumolo S, et al. Cetuximab plus chronomodulated irinotecan, 5-fluorouracil, leucovorin and oxaliplatin as neoadjuvant chemotherapy in colorectal liver metastases: POCHER trial. Br J Cancer. 2010;103:1542-1547.
[26]Folprecht G, Gruenberger T, Bechstein WO, et al. Tumour response and secondary resectability of colorectal liver metastases following neoadjuvant chemotherapy with cetuximab: the CELIM randomised phase 2 trial. Lancet Oncol. 2010;11:38-47.
[27]Venook A, Niedzwiecki D, Lenz H, et al. CALGB/SWOG 80405: analysis of patients undergoing surgery as part of treatment strategy. Ann Oncol. 2014;25:1-41 LBA10.
未完,待续。。。。。。
医脉通编译自:Biologic Therapies in Colorectal Cancer: Indications and Contraindications,2015 ASCO Educational Book
