医脉通编译,转载请注明出处
众所周知,在过去几年,癌症免疫治疗领域出现了很多抗癌疫苗,其中有几个在Ⅱ期临床试验中获得阳性数据,然而无一例外的在Ⅲ期试验中失败了。而近期the Lancet Oncol. 发表的一项Ⅱb/Ⅲ期随机试验TIME研究的Ⅱb期结果,显示在一线标准化疗中加入抗癌疫苗TG4010显著改善了患者的PFS和缓解率,亚组分析显示TG4010对非鳞癌患者和特定分子类型的患者有更好的改善。相关述评作者解释了免疫治疗过程需要解决的关键问题,并认为TG4010存在成功的可能性。医脉通报道。
在过去的几年里,癌症免疫治疗重新获得了人们的关注。大多数令人兴奋的成果来自于晚期黑色素瘤和非小细胞肺癌(NSCLC)治疗领域中,免疫检查点抑制剂随机Ⅲ期试验的阳性结果。两项关于PD-1单克隆抗体nivolumab的Ⅲ期临床试验显示1,2,与标准细胞毒化疗相比,nivolumab二线治疗晚期NSCLC显著改善了总生存和缓解率。另一项研究显示,第二个抗PD-1细胞死亡途径的药物pembrolizumab也显示出相似的效果。
相反的,治疗性癌症疫苗策略并未能显示出NSCLC治疗获益。尽管有三个不同的疫苗(MAGE-A33,tecemotide4,belagenpumatucel-L5)在随机Ⅱ期临床试验中显示出了阳性数据,但是在大样本良好设计的Ⅲ期试验中,这三种疫苗均为显示出显著获益。The Lancet Oncology近期发表了Quoix团队关于另一种新型癌症疫苗TG4010治疗晚期NSCLC研究6的阳性结果。这项随机Ⅱb/Ⅲ期试验TIME研究的Ⅱb期试验部分的结果显示,在晚期NSCLC一线标准化疗方案中加入TG4010可以显著改善患者的无进展生存(PFS)和缓解率。在特定亚组中(包括非鳞癌,TrPAL值≤Q3),与对照组化疗+安慰剂方案相比,化疗+TG4010也能显著改善总生存。此外,该研究似乎证实了一个潜在的生物标志物——CD16、CD56、CD69三阳性活化淋巴细胞——可以用来筛选更有可能从TG4010治疗获益的患者,只是确切阈值尚未确定。
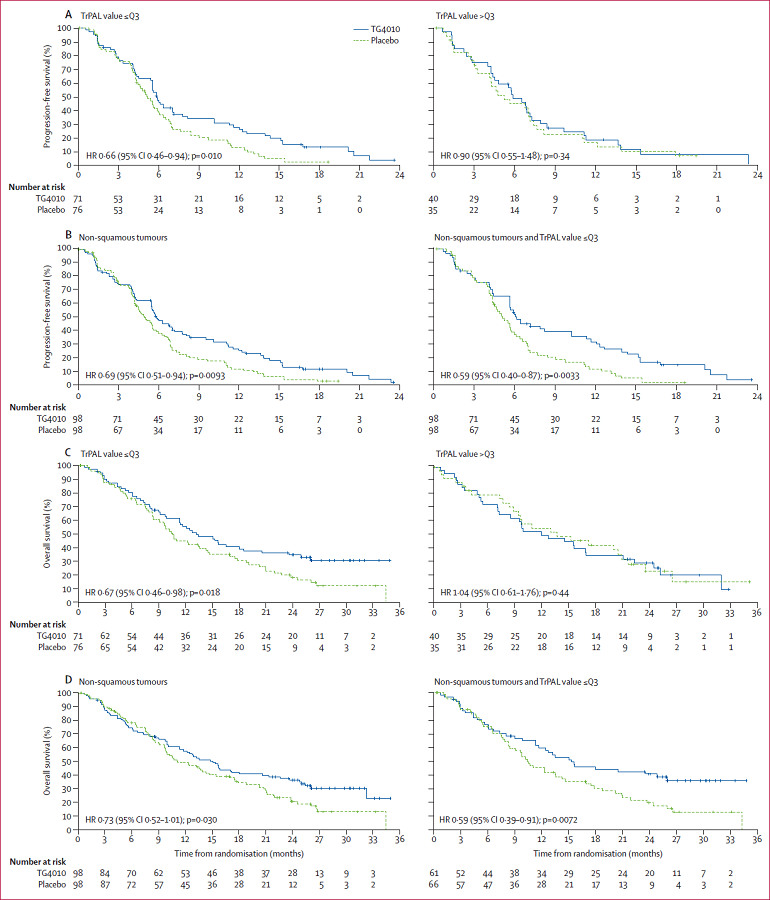
不同亚型的PFS和OS数据(点击查看大图)
但是很明显的,人们会提出问题:该疫苗与其它已经失败的疫苗的不同之处在哪?是否有希望获得成功呢?
TG4010是一种能够编码MUC1肿瘤相关抗体和白细胞介素2(IL-2)的重组修饰牛痘病毒的悬浊液。MUC1能够提供抗原刺激介导细胞应答,同时病毒载体用来增加免疫应答。IL-2的作用是优化抗原递呈至T细胞的过程7。此外,病毒载体被设计成限制IL-2在注射位点的分泌,以避免可能的全身毒性作用。TIME研究设置的条件用来优化MUC1特异性T细胞活化成功。患者在入组时均有超过50%的肿瘤细胞MUC1染色阳性,以保证有靶点的表达。标准化疗与TG4010同步给予,以增强免疫应答8。最后,研究人员还测定了活动的自然杀伤细胞(NK细胞)的基础浓度,以确保进一步筛选可能对疫苗应答的患者群。
一个抗癌疫苗想要成功面临很多困难9。必须能实现将一个合适的抗原呈递给树突细胞,而树突细胞必须接受到合适的活化信号才能加工和递呈抗原。随后树突细胞必须到达淋巴器官,并出于成熟期,以激活效应T细胞应答。就算是所有这些必要的过程都成功了,完成了T细胞活化,T细胞还需要达到肿瘤微环境,克服肿瘤细胞用于避免T细胞识别的很多免疫抑制机制。之前抗癌疫苗失败的一种很有可能的解释是没有设计能够充分的解决免疫抑制方面的策略。而检查点抑制剂解决了肿瘤细胞对T细胞的负信号或抑制信号,从而获得了成功,证明了这对于解决肿瘤介导的免疫抑制非常重要。正如Ribas在一篇文章中提到的一样10,治疗策略已经从努力激活免疫应答,转变为“松开T细胞的负信号刹车”。
这项Ⅱb期试验TIME研究6所考察的TG4010疫苗以及相关的生物标志物已经显示出了可喜的结果,改善了预后并将毒性反应最小化。该疫苗的设计策略以及Ⅲ期试验部分设置的条件都将能进一步增加T细胞活化的可能性。单靠疫苗本身的设计策略而不需要其它专门的解决肿瘤介导的免疫抑制方案的辅助,能否足以获得成功,尚需在Ⅲ期试验中确认。
参考文献
1. Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med 2015;373: 123–35.
2. Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med 2015;373: 1627–39.
3. Vansteenkiste JF, Cho B, Vanakesa T, et al. MAGRIT: a double-blind, randomised, placebo-controlled phase III study to assess the efficacy of recMAGE-A3 + AS15 cancer immunotherapeutic as adjuvant therapy in patients with resected MAGE-A3-positive non-small cell lung cancer (NSCLC). Ann Oncol 2014; 25 (suppl 4): iv409.
4. Butts C, Socinski MA, Mitchell PL, et al. Tecemotide (L-BLP25) versus placebo after chemoradiotherapy for stage III non-small-cell lung cancer (START): a randomised, double-blind, phase 3 trial. Lancet Oncol 2014;15: 59–68.
5. Giaccone G, Bazhenova LA, Nemunaitis J, et al. A phase III study of belagenpumatucel-L, an allogeneic tumour cell vaccine, as maintenance therapy for non-small cell lung cancer. Eur J Cancer 2015; 51: 2321–29.
6. Quoix E, Lena H, Losonczy G. TG4010 immunotherapy and first-line chemotherapy for advanced non-small-cell lung cancer (TIME): results from the phase 2b part of a randomised, double-blind, placebo-controlled, phase 2b/3 trial. Lancet Oncol 2015; published online Dec 22. http://dx.doi.org/10.1016/S1470-2045(15)00483-0.
7. Boyman O, Sprent J. The role of interleukin-2 during homeostasis and activation of the immune system. Nat Rev Immunol 2012; 12: 180–90.
8. Lake RA, Robinson BW. Immunotherapy and chemotherapy—a practical partnership. Nat Rev Cancer 2005; 5: 397–405.
9. Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age. Nature 2011; 480: 480–89.
10. Ribas A. Releasing the brakes on cancer immunotherapy. N Engl J Med 2015;373: 1490–92.
原文编译自:TIME for a s uccessful cancer vaccine in NSCLC? Lancet Oncol Published Online December 22, 2015
