医脉通编译整理,转载请务必注明出处。
近日,FDA批准靶向药物Olaratumab获得生物制品许可申请(BLA)的优先审评资格。Olaratumab联合多柔比星方案对放疗和手术治疗失败的晚期软组织肉瘤表现出一定的治疗潜力。
Olaratumab是人源IgG1单克隆抗体,对人血小板衍生生长因子受体α(Platelet-derived Growth Factor Receptor α,PDGFRα)有较高的靶向亲和力。部分研究发现PDGFRα在多种肿瘤组织中表达,而且该受体的异常激活与肿瘤有一定的关系。临床前研究认为,PDGFRα可能会增加肿瘤的增殖和转移潜能。
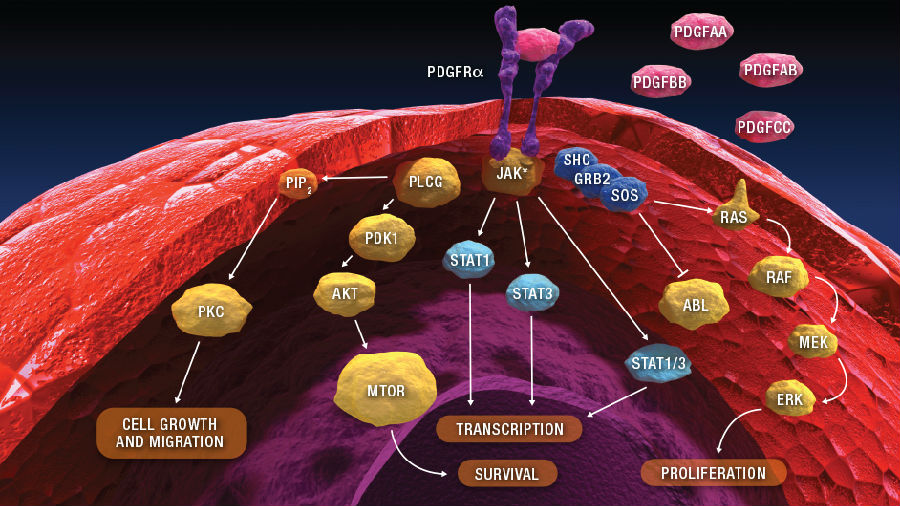
(图片来自lillyoncologypipeline.com,PDGFRα下游通路)
Olaratumab的设计初衷是阻断肿瘤细胞和微环境中的PDGFRα信号通路,针对此种作用模式,Olaratumab还通过了FDA“突破性药物”、“快速通道”和“孤儿药”的审批。加上BLA的优先审评资格,如果证实该药的临床作用,将会为软组织肉瘤这一少见而难治疾病的治疗提供新的选择。
此次Olaratumab的BLA申请是基于一项开放标签Ⅱ期随机临床研究(clinicaltrials.gov编号:NCT01185964)的结果,该研究比较了Olaratumab+多柔比星VS多柔比星单药对晚期软组织肉瘤的疗效,主要临床终点是PFS,次要临床终点是OS。研究结果在2015 ASCO年会和2015 CTOS(结缔组织肿瘤学会)年会发布。对于无法切除的晚期软组织肉瘤患者(129例),Olaratumab+多柔比星治疗组对比多柔比星单药治疗组,最终的中位PFS(月)有所提高(6.6>4.1),期中分析中位OS增加(25.0>14.7),但客观缓解率上两者并不具有显著性差异。
该研究是第一次将Olaratumab与多柔比星联用治疗晚期或转移性软组织肉瘤,虽然不能避免患者死亡的结局(期中分析时死亡83例),但OS表现出显著的改善。
关于Olaratumab+多柔比星方案治疗晚期软组织肉瘤的进一步研究,目前一项多中心的Ⅲ临床试验(clinicaltrials.gov编号:NCT02451943)正在开展。
打开微信 →→ 添加“医脉通肿瘤科”公众号,或扫描电脑屏幕右上方二维码 →→ 关注医脉通肿瘤科。随时随地获取肿瘤前沿资讯,一次打包最实用的肿瘤治疗知识。做科研达人、临床高手,尽在医脉通肿瘤频道。
信源:FDA Grants Priority Review for BLA for Olaratumab in Advanced Soft-Tissue Sarcoma. ascopost.com. May 4 2016.
