医脉通整理,转载请务必注明出处。
2016年6月3日-7日,美国临床肿瘤学会(ASCO)2016年会在美国芝加哥盛大召开。本次大会中国学者取得了口头报告新突破:大陆有4项入选,台湾有3项入选。当地时间6月5日上午头颈部肿瘤专场,来自复旦大学附属肿瘤医院、上海市质子重离子医院的孔琳教授口头报告了一项局部晚期鼻咽癌同步放化疗与放疗同步尼妥珠单抗的对比研究(Abstract No:6002)。会后,医脉通有幸采访到孔琳教授。

孔琳教授
调强适形放疗(IMRT)是鼻咽癌的标准治疗手段之一,对于局部晚期患者来说,同步放疗+顺铂是标准治疗,同步放疗+尼妥珠单抗方案也是可选择的治疗。在临床实践中,同步放化疗存在毒性较大的问题,患者治疗过程比较痛苦。
尼妥珠单抗最初由古巴研制成功,是新一代人源化靶向EGFR单抗,2008年获得SFDA批准上市用于恶性肿瘤的治疗。由于前期在鼻咽癌国内临床试验中较好的疗效和安全性,尼妥珠单抗2009年进入《NCCN临床实践指南(中国版)》,成为推荐药物之一。
摘要编号:6002
时间:6月5日,上午8:00-11:30
报告形式:口头报告
主要研究内容
局部晚期鼻咽癌患者主要入组标准:
◆年龄18-70岁
◆组织学证实为低分化或未分化鼻咽癌
◆TNM分期为Ⅲ期或ⅣA/B期
◆KPS>70
◆骨髓造血、肝肾功能耐受
◆疾病无转移
自2012年7月至2015年11月,研究最终纳入155例局部晚期鼻咽癌患者,所有患者均先接受多西他赛+顺铂+5Fu(TPF)方案诱导化疗,随机分配进入顺铂同步放疗组(73例)和尼妥珠单抗同步放疗组(82例)。
主要终点是放射相关3-4级粘膜、皮肤毒性反应事件,次要终点是总体生存(OS)、疾病无进展生存(PFS)。
主要结果
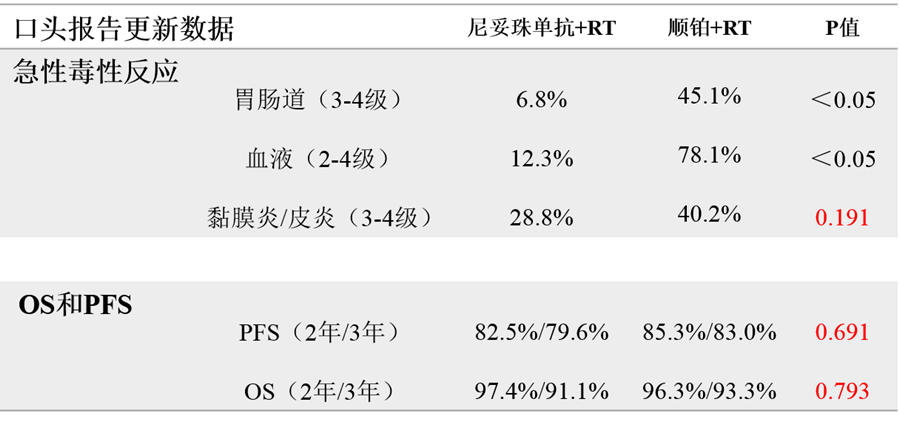
所有患者均完成同步放疗计划,但顺铂化疗(5周期)与尼妥珠单抗(8周期)治疗计划完成率差异巨大,分别为40.2% vs 97.3%。
黏膜炎/皮炎在顺铂+RT组高于尼妥珠单抗+RT组,分别为40.2%和28.8%,但无统计学差异。
消化道毒性反应发生率在顺铂+RT组显著高于尼妥珠单抗+RT组,分别为45.1% vs 6.8%。
血液毒性反应发生率在顺铂+RT组依然明显高于尼妥珠单抗+RT组,分别为78.1% vs 12.3%。
中位随访24个月,期中分析显示OS和PFS在两组近似。
不良反应事件发生率和临床终点对比见下表:
结论
在中国版NCCN指南中,尼妥珠单抗已经成为局部晚期鼻咽癌的治疗选择之一。该研究证实:在放疗中,同期采用尼妥珠单抗治疗具有和顺铂相近的PFS和OS,重要的是,尼妥珠单抗在胃肠道和血液学毒性方面耐受性表现良好。
孔琳教授采访实录
医脉通在头颈部肿瘤专场口头报告结束后第一时间采访了孔琳教授。
医脉通:孔教授您好,您刚才的报告非常精彩。请问您和研究团队是如何想到将这两个治疗方案做对比的呢?
孔琳教授:我们的研究设计首先选用标准的同期放化疗做对照组,然后将放疗加尼妥珠单抗做研究组。尼妥珠单抗已经被中国的FDA批准上市,同时也已进入中国鼻咽癌NCCN指南并成为标准的治疗策略之一。但是目前这两种治疗方案没有做过随机的对比,因此我们想比较一下这两种治疗是不是有所不同。前期的研究证实尼妥珠单抗加放疗跟单纯放疗相比,毒性没有明显增加。虽然鼻咽癌的治疗效果很好,但同期放化疗时病人遭受了很大的痛苦,所以我们想用一个药物代替同期化疗降低毒性反应。当初估计两种方案在疗效上不会有差异,而放疗加尼妥珠单抗的毒性反应应该比顺铂会有所降低。
医脉通:根据您的报告,最后研究结果和预期是否一致。另外,这个研究的亮点有哪些?
孔琳教授:和预期是差不多的,现在是一个中期的分析。我们原计划入组320例患者,现在是160例,这两个治疗策略的急性毒副反应方面差异在12%左右,我们预期是会有15%的差异。疗效方面目前三年的随访结果没有看到差异,这个跟我们预期也是一样的。我们这个研究的亮点可能有几个方面,一个就是大样本Ⅲ期临床研究。另一个是设计的首要观察终点是急性毒副反应,这是一个可行的、科学的观察终点。
医脉通:您的这个研究中,在标准方案前使用诱导化疗,请问这样设计的目的是什么?
孔琳教授:加入诱导化疗主要是根据前期临床试验结果。我们前面做了2个Ⅱ期的研究,诱导化疗加同期放化疗获得了一个很好结果,三年总生存率超过90%。广州的同道们已经完成的一项研究的初步结果显示,诱导化疗加同期放化疗优于单纯的同期放化疗。
会议专题》》》2016年ASCO年会专题报道
摘要阅读
Abstract No:6002
Radiationplus concurrent nimotuzumab versus CDDP in locally advanced nasopharyngealcancer: Results of a phase III randomised trial
Session: Head and Neck Cancer
Type: Oral Abstract Session
Author(s): Lin Kong, Qin Lin,Jiade J Lu.et al.
Background: Nimotuzumab, a novelhumanized anti-EGFR monoclonal antibody, is one of the recommended concurrentregimen with radiotherapy (RT)for locally advanced nasopharyngeal cancer(LA-NPC)by the Chinese NCCN. However, concurrent nimotuzumab/RT has never beencompared with CDDP/RT, which is often associated with severe acute toxicities.The aim of this trial is to compare the efficacy and safety of the twocombinations in LA-NPC patients (pts).
Methods: Pts with stage III-IVBNPC were randomized and received concurrent RT(70 Gy/35 fractions)plus CDDP(40mg/m2/week) or nimotuzumab (200 mg/week x 8 week) after docetaxel/CDDP/5FU(TPF) induction chemotherapy (ICT). The primary and secondary endpoints wereGrade 3/4 acute toxicities occurred during or within 90 days after RT, overallsurvival (OS), progression-free survival (PFS). An interim analysis after 50%accrual of a total of 304 pts (to provide 80% of power to detect a 15%difference in the primary endpoint by 2-sided test, Type I error 5%) isrequired by the protocol.
Results: Between 7/2012 and11/2015, 155 pts were randomized and received RT plus nimotuzumab (82 pts) orCDDP (73 pts). All pts completed planned RT, but 97.3% vs. 40.2% completedplanned nimotuzumab (8 cycles) or CDDP (5 cycles) (P<0.001), respectively.GI and hematological toxicities were significantly higher in the CDDP group;however, PFS and OS rates were similar in both groups with a median follow-upof 24 months (range 3-42 mo) (Table).
Conclusions: Nimotuzumab producedsimilar PFS and OS as compared to CDDP with concurrent RT for LA-NPC, and it ishighly improbable to observe significant differences in PFS and OS between thetwo groups if the study is continued. GI and hematological toxicities weresignificantly less in pts treated with nimotuzumab. As the differences intoxicity are significant, early stop rule will be applied. Clinical trialinformation:NCT02012062.
打开微信 →→ 添加“医脉通肿瘤科”公众号,或扫描电脑屏幕右上方二维码 →→ 关注医脉通肿瘤科。随时随地获取肿瘤前沿资讯,一次打包最实用的肿瘤治疗知识。做科研达人、临床高手,尽在医脉通肿瘤频道。
