2017年6月28日-7月2日,2017年国家癌症中心学术年会暨2017国际胸外科学术大会(CITSAC 2017)在国家会议中心举行。6月30日,在“第二届中国肺癌精准医疗论坛”分会场中,吴一龙教授以“精准时代下临床研究设计的变革及优化”为题做出精彩报告,以下是报告的详细内容。

中国及世界临床研究现状
吴一龙教授指出,中国肺癌领域近10年取得了重要成果,均在一定程度上改变了临床实践。其中,精准医疗相关临床研究在其中占有很大比重。
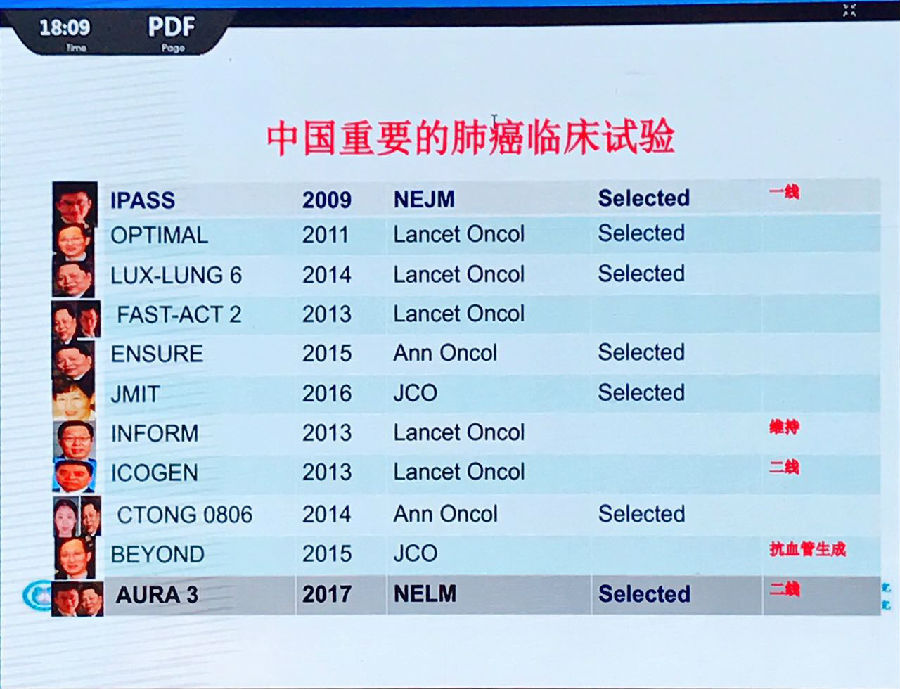
由于中国肺癌患者的基因特异性,绝大多数EGFR通路的临床研究均由中国主导。这些研究奠定了全球EGFR通路靶向治疗的循证医学证据基础,在国际上享有很高的学术地位。
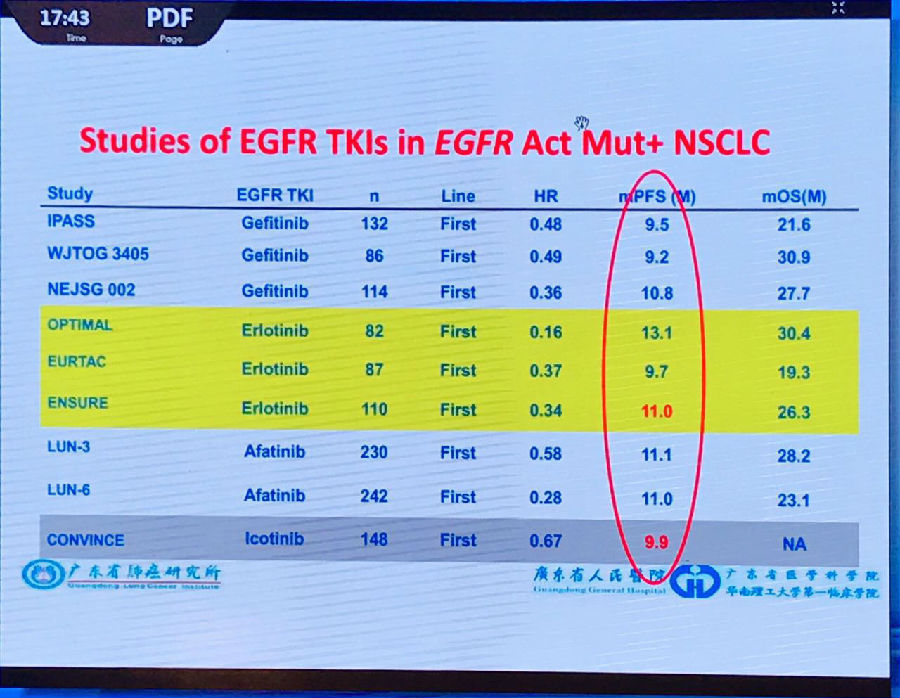
ALK通路的临床研究基本重复了EGFR的“故事”,并且有所创新:每次新一代药物的问世都对患者预后造成很大的影响。
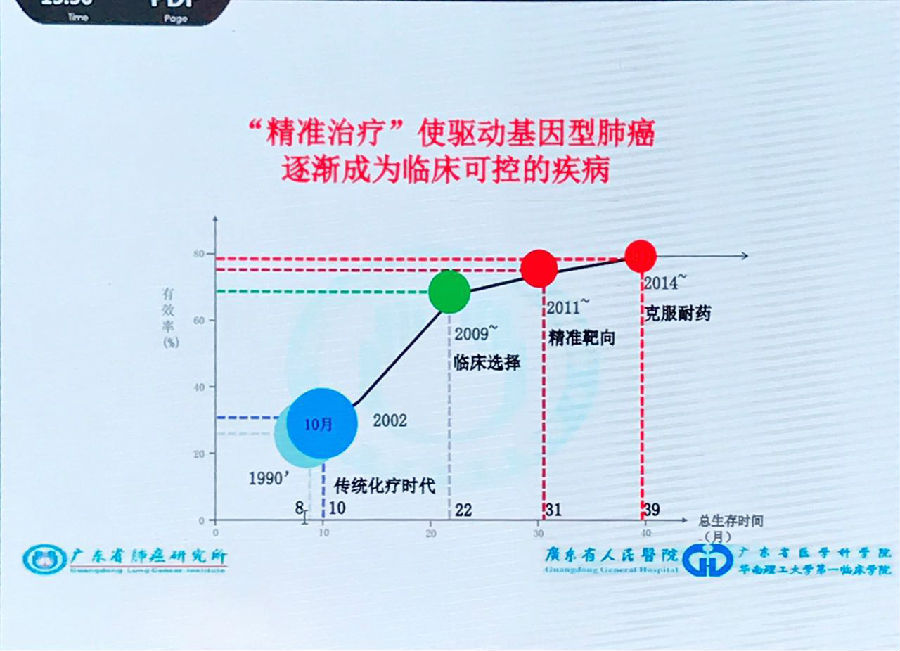
90年代,晚期肺癌患者的中位总生存(OS)仅为10个月左右,而现在接受精准治疗的患者OS可以达到40个月以上。在短短的20年间,这些驱动基因的出现大大改善了肺癌患者的生存结局,使肺癌成为临床可控的疾病。
这些药物特别需要良好设计的临床研究提供循证医学证据,才能用作临床实践。所以,对于临床试验设计的经验总结借鉴、变革和优化显得尤为重要。
临床试验的两大类型
吴一龙教授介绍道,第一种类型为经典的临床试验。

经典临床试验中,Ⅰ-Ⅳ期临床试验的研究目的较为固定,将未经选择的所有患者都纳入试验,进行随机分配后得出数据结果,持续时间也很漫长。
随着医生对患者的生物学、基因组学了解的愈发深入,导致看待肿瘤的方式有了很大改变,临床研究设计的改变也随着而来。
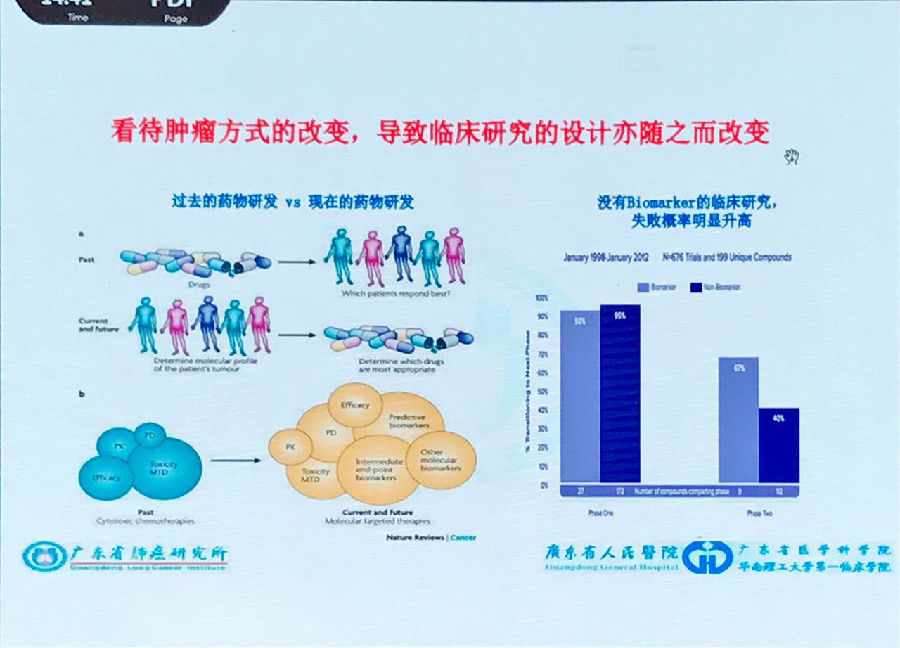
第一,过去的药物研发通过对发明的新型药物进行临床试验筛选出获益人群。而现在是通过患者的生物学、基因组学的差异来选择相应的药物进行试验入组。这二者的“颠倒”是药物研发领域重要的变革。
第二,过去我们只关注药物的药代动力学、疗效及不良反应。而现在的临床研究还会关注预测生存、各个研究终点以及很多其他的分子标志物(Biomarkers)。
这两个改变使临床试验的成功率大大提高。
2014年JCO上Ellis等发表的文章对临床试验是否有意义做出了很好的判定标准(如下图)。
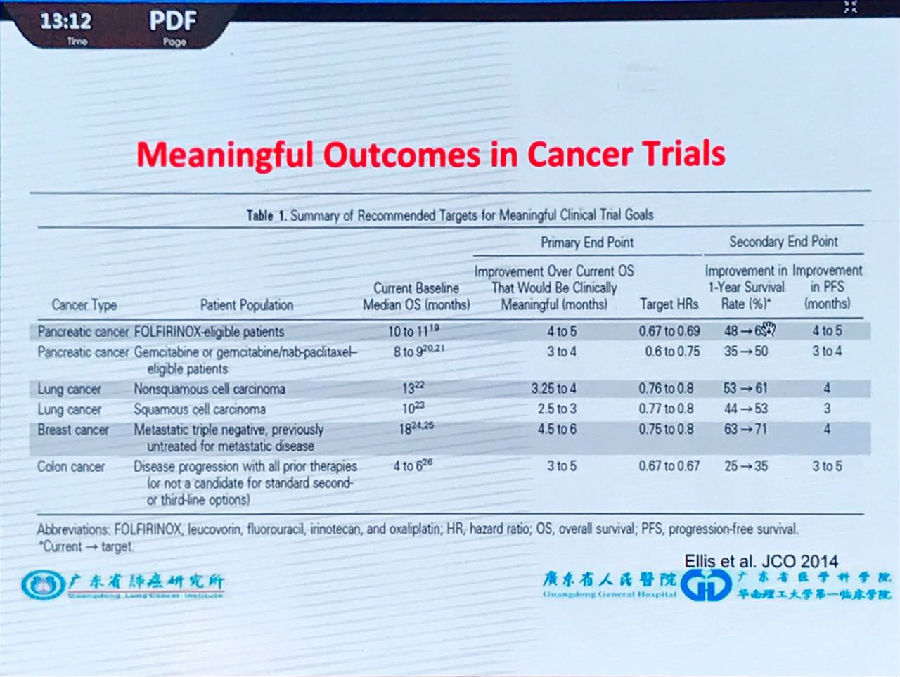
ASCO也对肺癌临床试验提供了相似的“门槛”:
如果研究终点为OS,在非鳞非小细胞肺癌中需超越原有干预手段3-4个月,鳞癌中需超越2-3个月;
如果研究终点为PFS,非鳞非小细胞肺癌中需超越原有干预手段4个月,鳞癌中需超越3个月。
根据现有的经验来看,如果不针对Biomarkers做出筛选出精准人群,是很难达到该标准的。
经典案例
Nivolumab与pembrolizumab在NSCLC一线治疗中与化疗对比的Checkmate 026与Keynote 024研究是最经典的例子。
这两个研究中,Keynote 024得到了很好的结果,而Checkmate 026结果却不令人满意(如下图)。
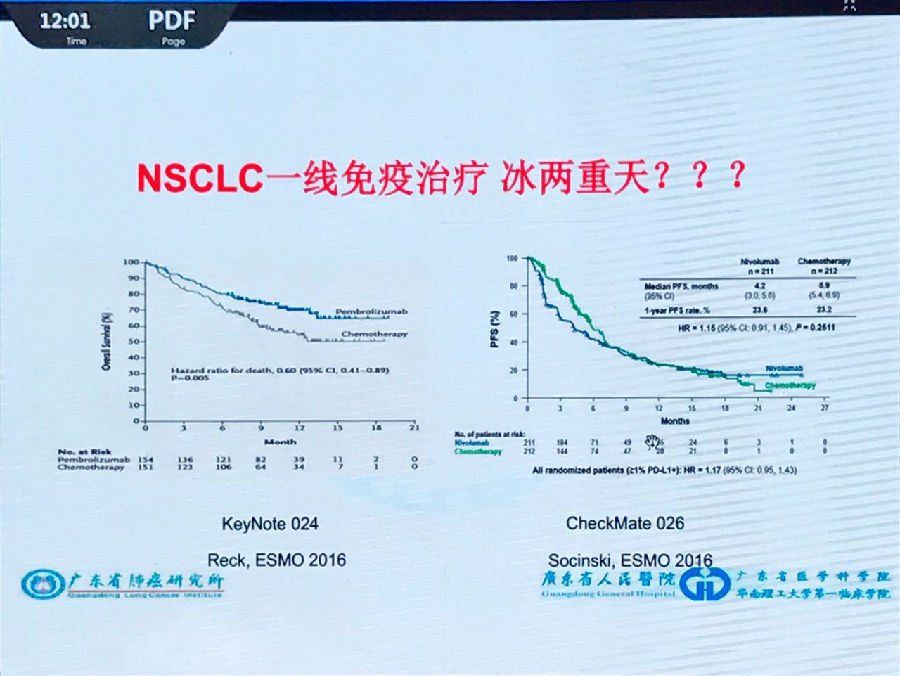
造成两个相似药物试验结果完全不同的原因之一就是Keynote 024和Checkmate 026两项研究PD-L1表达的筛选标准的不同(PD-L1表达水平≥50% vs ≥1%)。
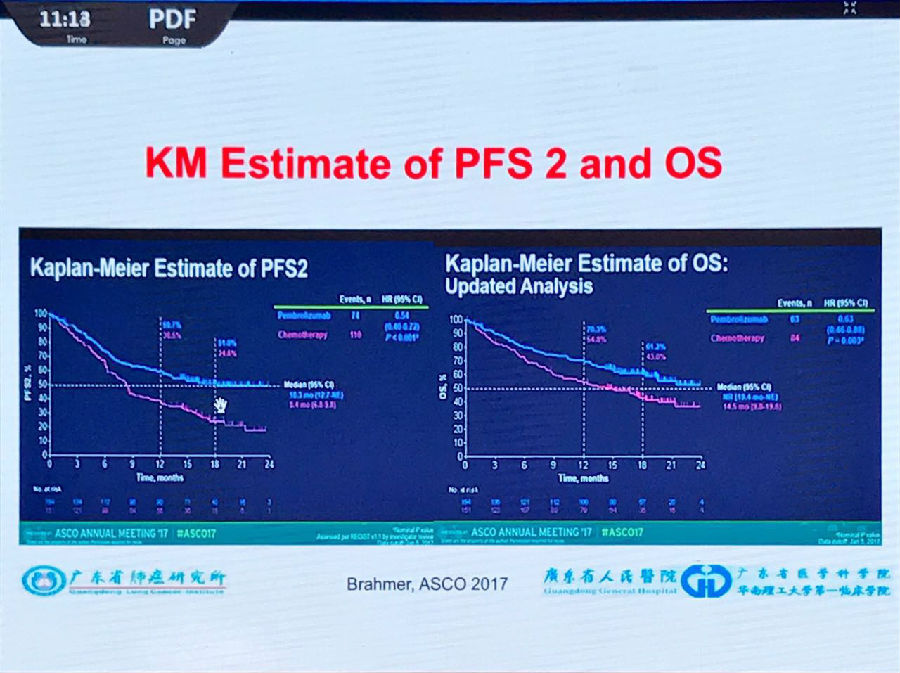
今年ASCO上,Keynote 024的结果进一步更新,PD-L1≥50%的患者中位PFS2的结果达到了24个月,并且50%的患者尚未达到研究终点。
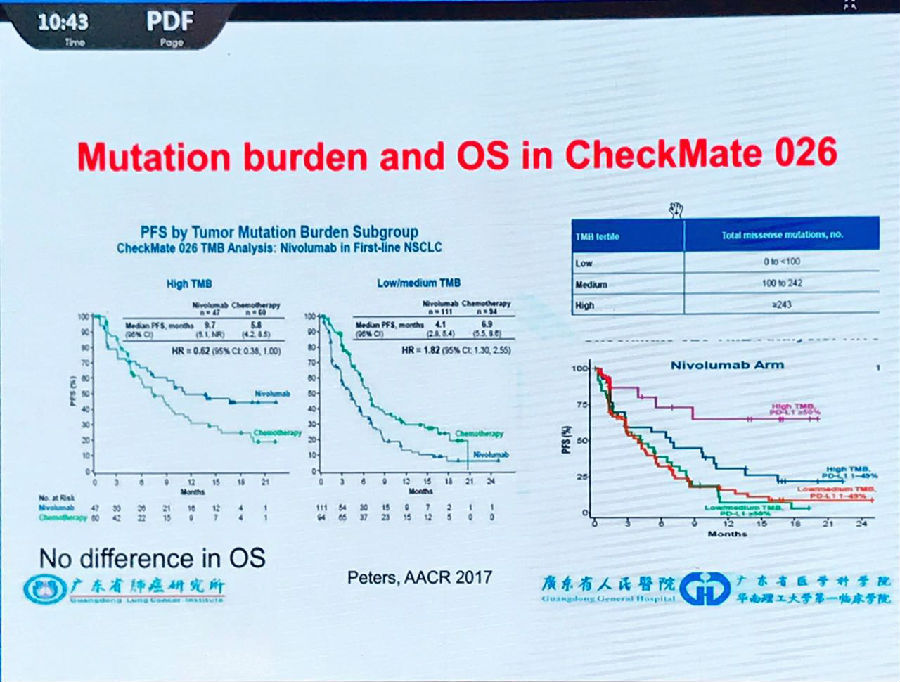
而Checkmate 026更新的最新亚组分析结果也说明,只要通过肿瘤突变负荷(TMB)、PD-L1表达情况进行亚组分析后,就可以筛选出明显获益的患者群。
所以,应用Biomarkers为导向的临床试验是现今的重要方向,直接关系到临床试验的成败。
Biomarkers为导向1/2期临床试验的特点
精准医学治疗和细胞毒药物的临床试验设计也有很大的差别(见下图):精准医学药物更重视长期毒性、具备更宽的剂量-疗效范围、非线性的剂量毒性关系、对减量和治疗暂停等问题也更加重视。

所以,精准医学的临床1/2期试验具有少见事件(样本量相对较小但需要筛查的样本较大)、有效率高、毒性较低等特点,很多临床研究也以PFS和RR等为主要终点,并且出现了Ⅰ期扩展试验、伞状和篮子试验等研究设计方法。
下图中可以看到,筛查工作在Biomarkers驱动的临床试验中的比重越来越大。
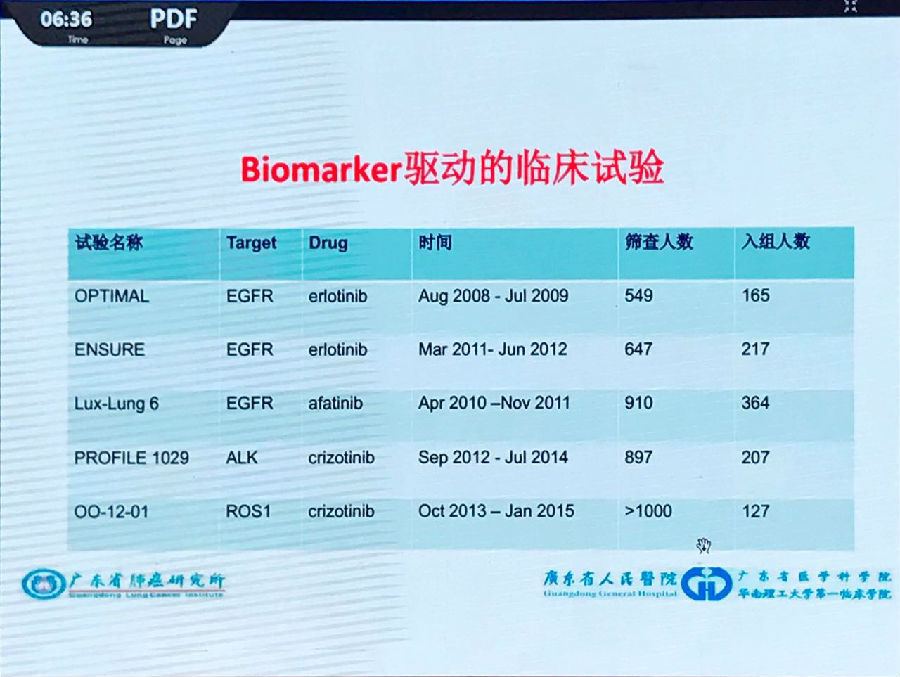
而在ALCHEMIST试验中,需要筛查6000-8000名患者才可以入组300-400人。

1期试验设计
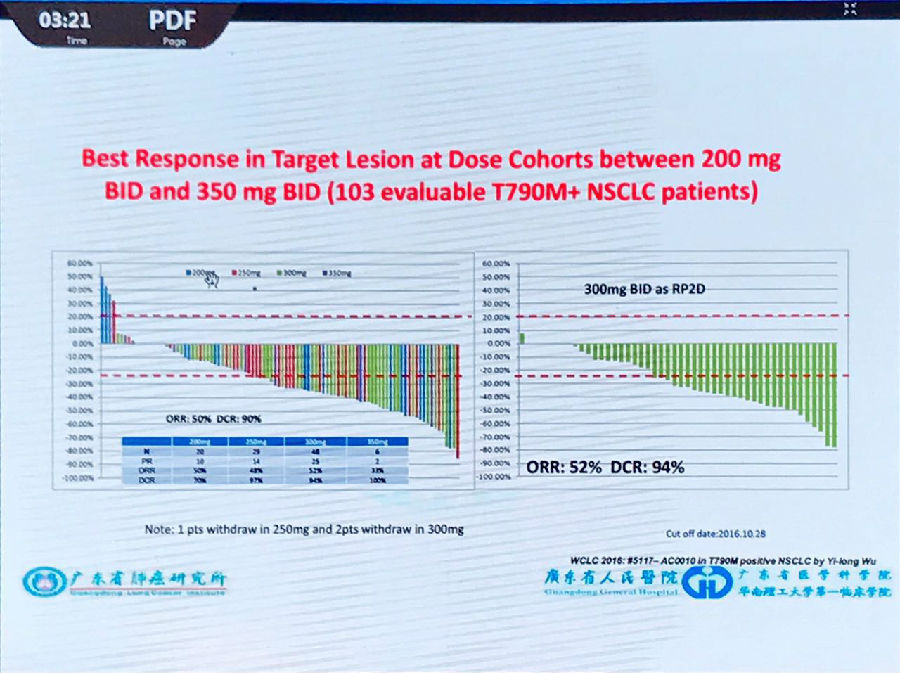
吴一龙教授以Avitinib的1期临床试验为例,介绍了如何设计新型的1期临床试验:在剂量爬坡时,当某一剂量组可观测到有效时,就应该将该剂量组的样本量扩大,而不只关注最大耐受剂量,以求综合有效性和安全性数据获得最佳剂量范围。

该研究中,全组患者的RR为42%,通过ORR、DCR和毒性的综合考虑,初步确定剂量范围后进一步分析,最终确定最佳剂量为300mg bid(ORR:52%)。
未来方向与展望
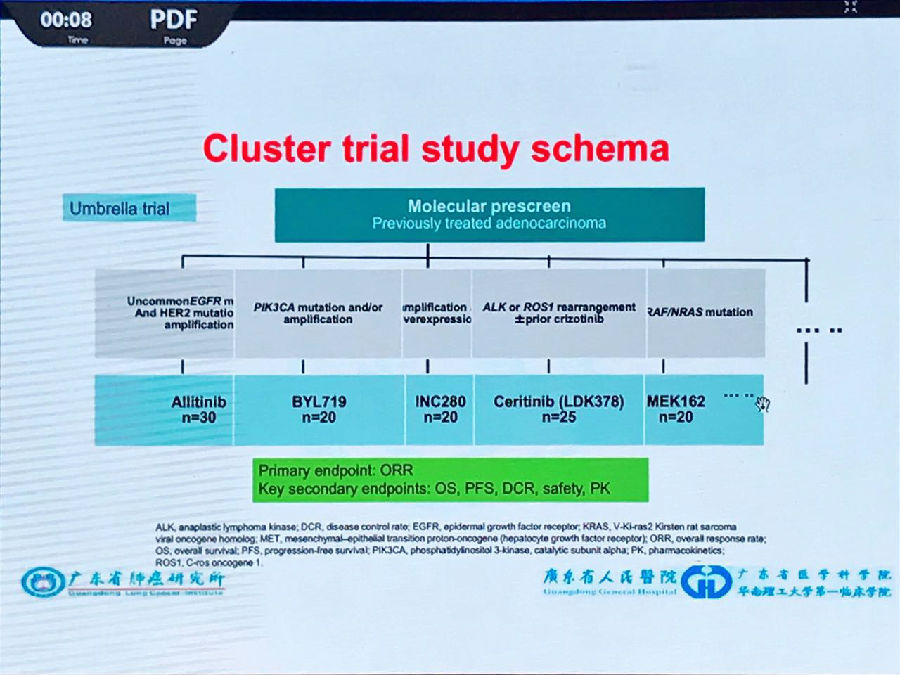
最近,篮状试验和伞状试验设计成为热议的焦点。这两中试验设计方法已经落地,相信将会成为以后很常见的试验设计方法。
篮状试验
上个月,FDA批准了PD-1抑制剂用于MSI-H或MMR缺陷的实体瘤患者。这是FDA首次批准根据Biomarkers为选择标准,不以癌种区分用药的适应症。

而该适应症的批准就是基于一项篮状试验,研究结果表明MSI-H或MMR缺陷亚组的实体瘤患者应用PD-1抑制剂可以达到53%的2年PFS和64%的2年OS。而入组患者中不乏子宫内膜癌、胃癌等过去认为缺乏治疗靶点的瘤种。
伞状试验
伞状试验设计现在主要应用于根据二代基因测序(NGS)等新型检测方法,针对一种疾病进行多靶点的检测后,确定最佳的靶点进行治疗的研究。

6月22日,FDA批准了dabrafenib联合trametinib在BRAF V600E突变阳性的转移性NSCLC中的适应症。同时,批准了首个NGS检测panel用于检测BRAF, ROS1和EGFR等基因突变。现在,我们中国自己的伞状试验和篮状试验也正在开展中。
展望
最后,吴一龙教授对未来做出了展望:
由于每个患者均具有特异的基因组学和生物学特性,未来我们可能针对单一患者开展个体化治疗的临床试验。
我们可能会对单个患者进行NGS检测、设计小分子化合物、观察疗效和安全性。最后通过大样本的汇总后,可能会得到超乎想象的结果。
