医脉通编译,转载请注明出处
近期,CA: A Cancer Journal for Clinicians 杂志发表了一篇关于分子基础上癌症预防的现状与展望的综述。综述回顾了各癌种分子预防的现状,并对未来进行了展望。医脉通编译了其中关于药物治疗乳腺癌癌前病变及降低癌症风险的部分。本篇为下半部分——AI、抗HER2治疗及三阴性乳腺癌的预防部分。
资讯上篇>>>CA:乳腺癌药物预防的现状与未来(上):SERMs
芳香化酶抑制剂
SERMs类药物能够调节雌激素活性,而芳香化酶抑制剂(AIs)是芳香化酶的阻断剂,能够抑制雄激素转化成雌激素。AIs类药物治疗激素受体阳性乳腺癌的临床试验表明(例如,单用或联用阿那曲唑、他莫昔芬试验[ATAC] [1,2]),AIs药物的疗效优于SERMs药物。基于这些试验的阳性结果,随后开展了一系列III期试验,以研究AIs类药物(例如,依西美坦和阿那曲唑)对高危乳腺癌的预防作用。[3-5,1] 第一项关于AIs类药物预防乳腺癌的研究是加拿大国家癌症研究所乳腺防治试验(NCIC-MAP3) ,该试验中,绝经后乳腺癌高危女性接受了为期5年,每天给予依西美坦或安慰剂的干预。[5] 试验结果显示,依西美坦减少了65%的浸润性乳腺癌和73%的ER阳性乳腺癌的发生。与针对SERMs的研究相同,AIs类药物并不能减少ER受体阴性乳腺癌的发生。第二项有关AIs药物预防试验,研究了阿那曲唑在绝经后高危女性中的预防作用,结果显示阿那曲唑对所有类型乳腺癌、浸润性乳腺癌、ER受体阳性乳腺癌的发生各减少了53%、50%和58%。[4] 与依西美坦试验相同,该实验并未观察到显著的ER受体阴性乳腺癌发病率的降低。然而,迄今为止,FDA尚未批准AIs药物用于乳腺癌预防。
同样的,AIs也在伴有导管原位癌(DCIS)病史的女性中进行了研究,以确定是否具有降低乳腺癌复发或对侧乳腺癌发生的效果。两项比较他莫昔芬与阿那曲唑对伴有DCIS病史绝经后女性的预防疗效的试验——国家乳房、胃肠外科和辅助项目(NSABP)B-35试验(国家临床试验编号NCT00053898)和第二次IBIS(IBIS-II)试验(DCIS)[1]正在进行之中。尽管这两项研究都达到了预期目标,但在结果分析之前仍需进一步随访。
HER2阳性乳腺癌
关于HER2癌基因的靶向药物能否有效地预防乳腺癌的研究,目前已有几项试验报道。最早的是2011年Kuerer及其同事关于抗HER2药物曲妥珠单抗用于HER2阳性DCIS患者的试验研究。[6] 在这项试验中,入组患者在手术前14至28天,被给予单剂量的曲妥珠单抗或安慰剂治疗。尽管切除的手术标本中HER2阳性DCIS的大小及生长速率无差异,但是在试验组中观察到了免疫反应。另一项曲妥珠单抗的III期试验紧随其后,该试验比较了2个单位曲妥珠单抗联合放疗、单药曲妥珠单抗及单用放疗在HER2阳性DCIS乳腺癌中的疗效,预计结果将在未来的几年内揭晓。
另外还有几项关于抗HER2药物拉帕替尼的II期试验,拉帕替尼能够同时抑制表皮生长因子受体(EGFR)和HER2酪氨酸受体激酶。临床前研究已经证明,在小鼠中拉帕替尼能够预防HER2阳性乳腺肿瘤的发生。[7] Decensi及其同事开展一项II期试验,该试验在术前向浸润性或非浸润性HER2阳性乳腺癌患者给予拉帕替尼或安慰剂,以研究拉帕替尼能否抑制乳腺癌细胞的生长。[8] 结果显示拉帕替尼能够抑制浸润性或非浸润性乳腺癌的增殖。第二项关于HER2阳性或EGFR阳性DCIS乳腺癌的术前II期临床试验正在进行中(NCT0055152)。这些试验结果将为抗HER2疗法治疗女性HER2阳性DCIS乳腺癌的III期试验的开展提供依据。
三阴性乳腺癌的预防
虽然抗雌激素药物已经证实能够预防ER阳性乳腺癌,HER2靶向药物的早期试验也证实了HER2靶向药物能够预防HER2阳性乳腺癌,但对于ER、PR、HER2均阴性的乳腺癌(TNBCs)目前尚未有预防措施。临床前和早期临床试验中提供了几种有可能能够预防这类癌症的药物,包括环加氧酶2(COX-2)抑制剂塞来昔布、类视黄醇、他汀类、没食子儿茶素(绿茶中提取的活性物质)以及抗糖尿病药物二甲双胍。[9-19]由于相关毒性反应,塞来昔布和类视黄醇的进一步临床开发已中止。[20-24] 一项正在进行的III期临床试验(NCT01101438),研究了二甲双胍(850mg bid对比安慰剂)作为早期术后乳腺癌的辅助治疗的疗效。该研究根据激素受体和HER2状态对患者进行分层,其结果可能会为将来二甲双胍作为乳腺癌(包括TNBCs)三级预防药物提供重要的信息。他汀类药物和没食子酸儿茶素的III期临床试验目前尚未在任一分子亚型的乳腺癌预防中开展。尽管我们已经揭示了药物预防ER阳性乳腺癌的有效性,但迄今为止三阴性乳腺癌的药物预防却毫无进展。
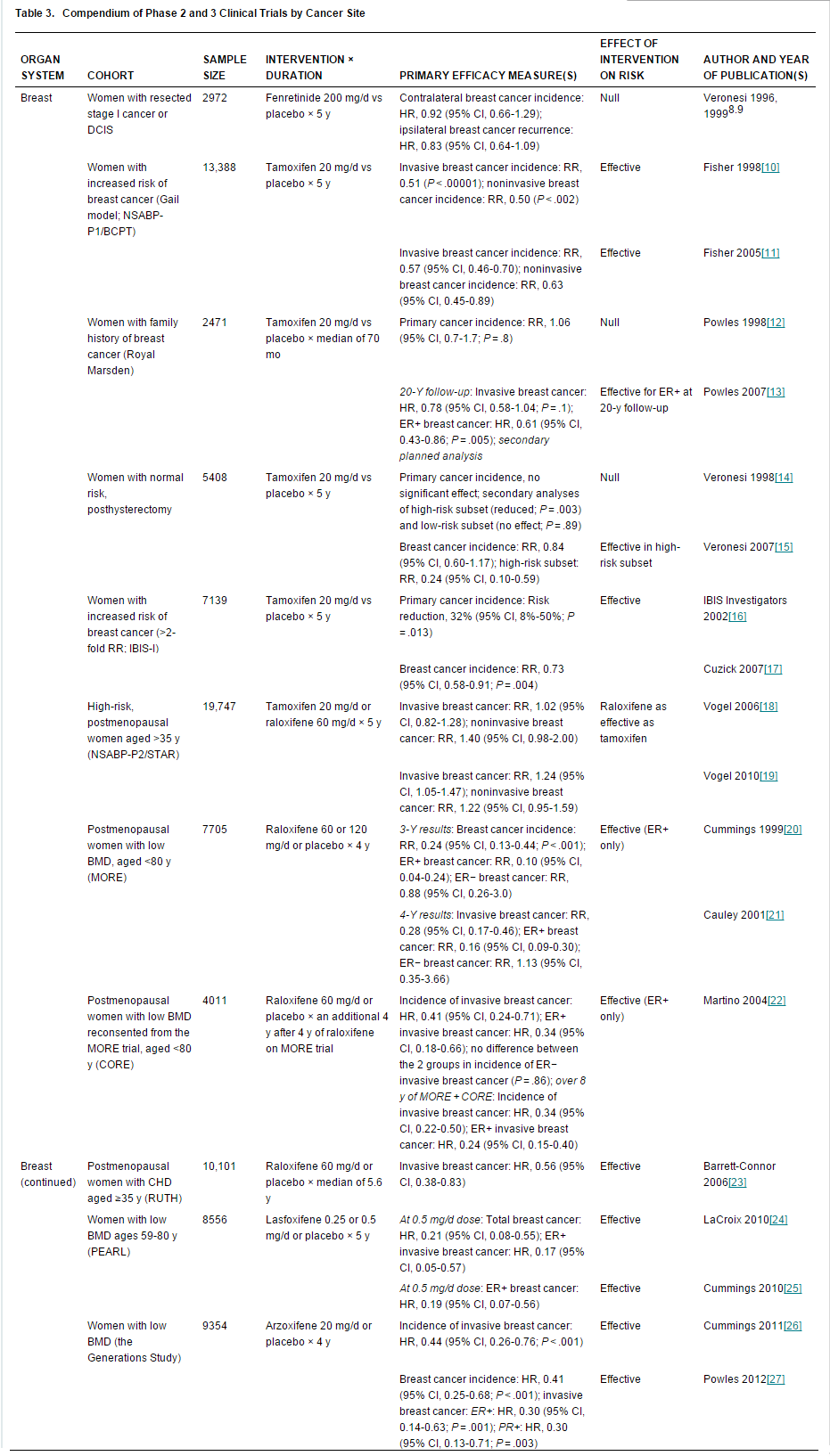
乳腺癌药物预防相关Ⅲ期临床试验(点击查看大图)
总结:
如表中所示,SERMs和AIs药物显著的预防功效已经在专门设计以评估其癌症预防疗效的III期药物预防试验中得到了证实。然而,它们仅对ER阳性乳腺癌有预防效果。他莫昔芬和雷洛昔芬是可供临床使用的两种降低乳腺癌风险的SERMs类药物,但在高危人群中因顾虑其毒副反应和难以权衡利弊,使得该类药物的使用率并不高。目前AIs药物尚未得到FDA的批准。因而,鲜有使用依西美坦和阿那曲唑预防乳腺癌(盲法用药)。美国预防服务工作组日前推荐,在患者作出知情决定后,临床医生可为35岁及以上疾病高风险、药物不良作用低风险的女性提供AIs。[25] 这是一项B级推荐,表明在减少高危女性浸润性乳腺癌的发病方面,他莫昔芬和雷洛昔芬具有高度或中度确定的中等净获益。2013年囊括所有9项SERMs试验的meta分析[26]及扩展的IBIS-I试验随访[27]——评估22名接受5年治疗的女性在未来20年里乳腺癌的预防作用,所得出的数据显示,从药物使用的利弊权衡来看长期治疗优于短期。至于这些数据能否有助于提高高危人群中药物的使用率还有待于观察,但结果强调了在给予预防性干预时,在整个生命长度的水平上权衡所有利益和风险的重要性。
参考文献:
1. Cuzick J, Sestak I, Baum M, et al. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer: 10-year analysis of the ATAC trial. Lancet Oncol. 2010;11:1135-1141.
2. Baum M, Budzar AU, Cuzick J, et al. Anastrozole alone or in combination with tamoxifen versus tamoxifen alone for adjuvant treatment of postmenopausal women with early breast cancer: first results of the ATAC randomised trial. Lancet. 2002;359:2131-2139.
3. Cuzick J. IBIS II. A breast cancer prevention trial in postmenopausal women using the aromatase inhibitor anastrozole. Expert Rev Anticancer Ther. 2008;8:1377-1385.
4. Cuzick J, Sestak I, Forbes JF, et al. Anastrozole for prevention of breast cancer in high-risk postmenopausal women (IBIS-II): an international, double-blind, randomised placebo-controlled trial. Lancet. 2014;383:1041-1048.
5. Goss PE, Ingle JN, Ales-Martinez JE, et al. Exemestane for breast-cancer prevention in postmenopausal women. N Engl J Med. 2011;364:2381-2391.
6. Kuerer HM, Buzdar AU, Mittendorf EA, et al. Biologic and immunologic effects of preoperative trastuzumab for ductal carcinoma in situ of the breast. Cancer. 2011;117:39-47.
7. Strecker TE, Shen Q, Zhang Y, et al. Effect of lapatinib on the development of estrogen receptor-negative mammary tumors in mice. J Natl Cancer Inst. 2009;101:107-113.
8. Decensi A, Puntoni M, Pruneri G, et al. Lapatinib activity in premalignant lesions and HER-2-positive cancer of the breast in a randomized, placebo-controlled presurgical trial. Cancer Prev Res (Phila). 2011;4:1181-1189.
9. Harris RE, Alshafie GA, Abou-Issa H, Seibert K. Chemoprevention of breast cancer in rats by celecoxib, a cyclooxygenase 2 inhibitor. Cancer Res. 2000;60:2101-2103.
10. Howe LR, Subbaramaiah K, Patel J, et al. Celecoxib, a selective cyclooxygenase 2 inhibitor, protects against human epidermal growth factor receptor 2 (HER-2)/neu-induced breast cancer. Cancer Res. 2002;62:5405-5407.
11. Anzano MA, Byers SW, Smith JM, et al. Prevention of breast cancer in the rat with 9-cis-retinoic acid as a single agent and in combination with tamoxifen. Cancer Res. 1994;54:4614-4617.
12. Wu K, Kim HT, Rodriquez JL, et al. 9-cis-Retinoic acid suppresses mammary tumorigenesis in C3(1)-simian virus 40 T antigen-transgenic mice. Clin Cancer Res. 2000;6:3696-3704.
13. Campbell MJ, Esserman LJ, Zhou Y, et al. Breast cancer growth prevention by statins. Cancer Res. 2006;66:8707-8714.
14. Garwood ER, Kumar AS, Baehner FL, et al. Fluvastatin reduces proliferation and increases apoptosis in women with high grade breast cancer. Breast Cancer Res Treat. 2010;119:137-144.
15. Kumar AS, Benz CC, Shim V, Minami CA, Moore DH, Esserman LJ. Estrogen receptor-negative breast cancer is less likely to arise among lipophilic statin users. Cancer Epidemiol Biomarkers Prev. 2008;17:1028-1033.
16. Crew KD, Brown P, Greenlee H, et al. Phase IB randomized, double-blinded, placebo-controlled, dose escalation study of polyphenon E in women with hormone receptor-negative breast cancer. Cancer Prev Res (Phila). 2012;5:1144-1154.
17. Xue F, Michels KB. Diabetes, metabolic syndrome, and breast cancer: a review of the current evidence. Am J Clin Nutr. 2007;86:s823-s835.
18. Niraula S, Dowling RJ, Ennis M, et al. Metformin in early breast cancer: a prospective window of opportunity neoadjuvant study. Breast Cancer Res Treat. 2012;135:821-830.
19. Bonanni B, Puntoni M, Cazzaniga M, et al. Dual effect of metformin on breast cancer proliferation in a randomized presurgical trial. J Clin Oncol. 2012;30:2593-2600.
20. Baron JA, Sandler RS, Bresalier RS, et al. Cardiovascular events associated with rofecoxib: final analysis of the APPROVe trial. Lancet. 2008;372:1756-1764.
21. Graham DJ, Campen D, Hui R, et al. Risk of acute myocardial infarction and sudden cardiac death in patients treated with cyclo-oxygenase 2 selective and non-selective non-steroidal anti-inflammatory drugs: nested case-control study. Lancet. 2005;365:475-481.
22. Kerr DJ, Dunn JA, Langman MJ, et al. Rofecoxib and cardiovascular adverse events in adjuvant treatment of colorectal cancer. N Engl J Med. 2007;357:360-369.
23. Ross JS, Madigan D, Konstam MA, Egilman DS, Krumholz HM. Persistence of cardiovascular risk after rofecoxib discontinuation. Arch Intern Med. 2010;170:2035-2036.
24. Schjerning Olsen AM, Fosbol EL, Lindhardsen J, et al. Duration of treatment with nonsteroidal anti-inflammatory drugs and impact on risk of death and recurrent myocardial infarction in patients with prior myocardial infarction: a nationwide cohort study. Circulation. 2011;123:2226-2235.
25. Nelson HD, Smith ME, Griffin JC, Fu R. Use of medications to reduce risk for primary breast cancer: a systematic review for the US Preventive Services Task Force. Ann Intern Med. 2013;158:604-614.
26. Cuzick J, Sestak I, Bonanni B, et al. Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data. Lancet. 2013;381:1827-1834.
27. Cuzick J, Sestak I, Cawthorn S, et al. Tamoxifen for prevention of breast cancer: extended long-term follow-up of the IBIS-I breast cancer prevention trial. Lancet Oncol. 2015;16:67-75.
原文编译自:Molecular cancer prevention: Current status and future directions. CA Cancer J Clin 2015 Aug 18.
