2017年7月7日,由中国临床肿瘤学会(CSCO)携手美国临床肿瘤学会(ASCO)于“临床肿瘤学新进展学术研讨会――(Best of ASCO® Event in China)于上海富悦大酒店召开。7月8日乳腺癌专场中,在陆劲松教授汇报及解读后,殷咏梅教授对ASCO上LBA500、504以及506三个研究摘要的内容进行了深度剖析和点评。

殷咏梅教授介绍道,APHINITY(LBA 500),PlanB(504),I-SPY2(506)分别为针对抗HER-2辅助治疗、辅助化疗和免疫治疗最佳策略的探索,下面是z这三大方面的详细内容。
抗HER-2辅助治疗
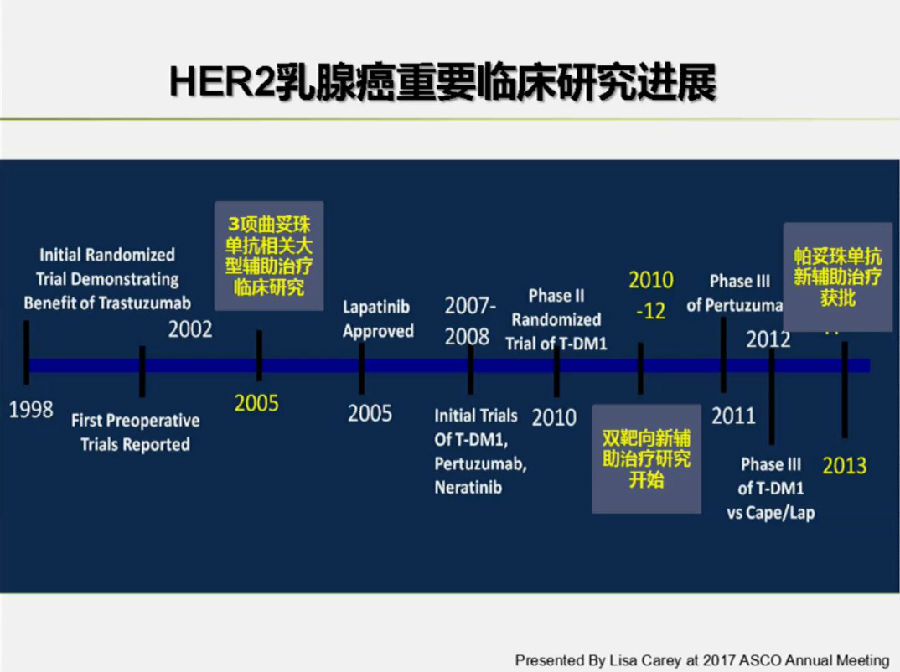
随着抗HER-2药物的逐渐问世,给HER-2阳性乳腺癌早期辅助、新辅助及晚期解救治疗带来了越来越多的选择。
2005年,随着HERA等曲妥珠单抗辅助治疗的大型临床研究结果陆续公布,奠定了曲妥珠单抗在早期HER-2阳性乳腺癌辅助治疗中的地位。
那么,加入曲妥珠单抗后,是不是早期HER-2阳性乳腺癌患者就可以完全治愈了呢?
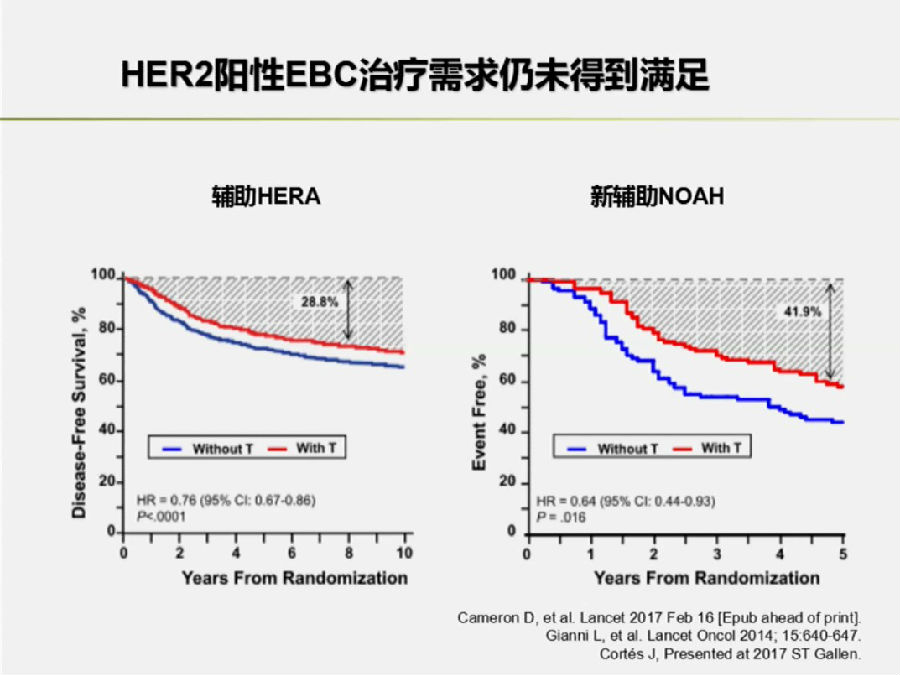
在HERA研究中,加入曲妥珠单抗行辅助治疗后,有28%的早期HER-2+患者在8年内出现复发。
而NOAH研究提示,在加入曲妥珠单抗行新辅助治疗后,仍有41.9%的HER-2+患者在5年内出现复发。
所以,在早期HER-2+患者的抗HER-2治疗尚需进一步探索和提高。
APHINITY研究
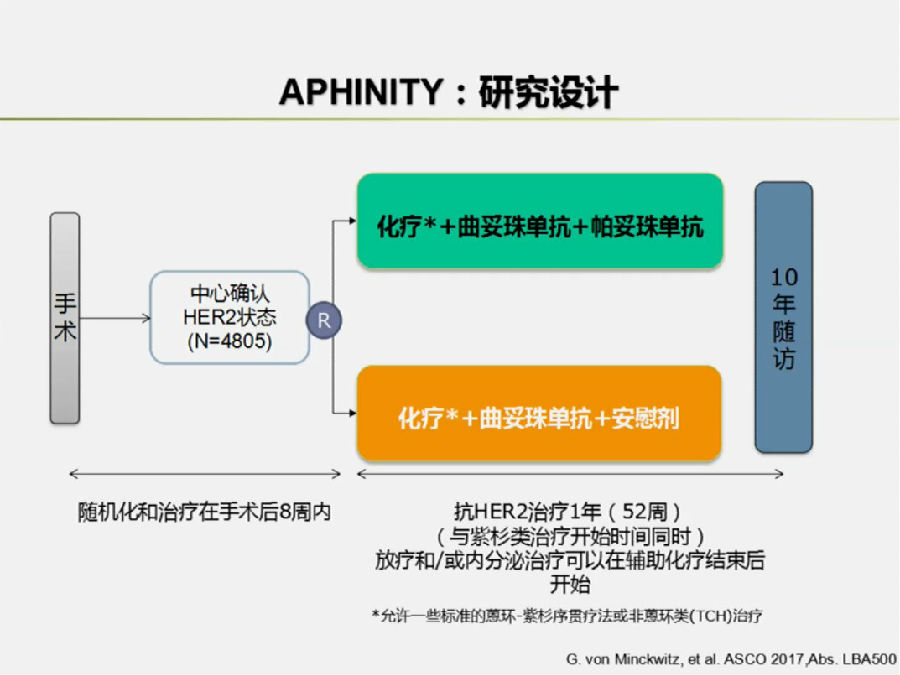
APHINITY研究(LBA 500)目的是探究在HER-2+早期乳腺癌的辅助治疗中,在化疗联合曲妥珠单抗的基础上加入帕妥珠单抗是否可以带来进一步的获益(研究设计见下图)。
结果显示,在ITT人群中,双靶向+化疗组较单靶向+化疗组可改善4年无浸润疾病生存期(iDFS):92.3% vs 90.6%(HR, 0.81; 95%CI, 0.66-1.00, p=0.0446)。
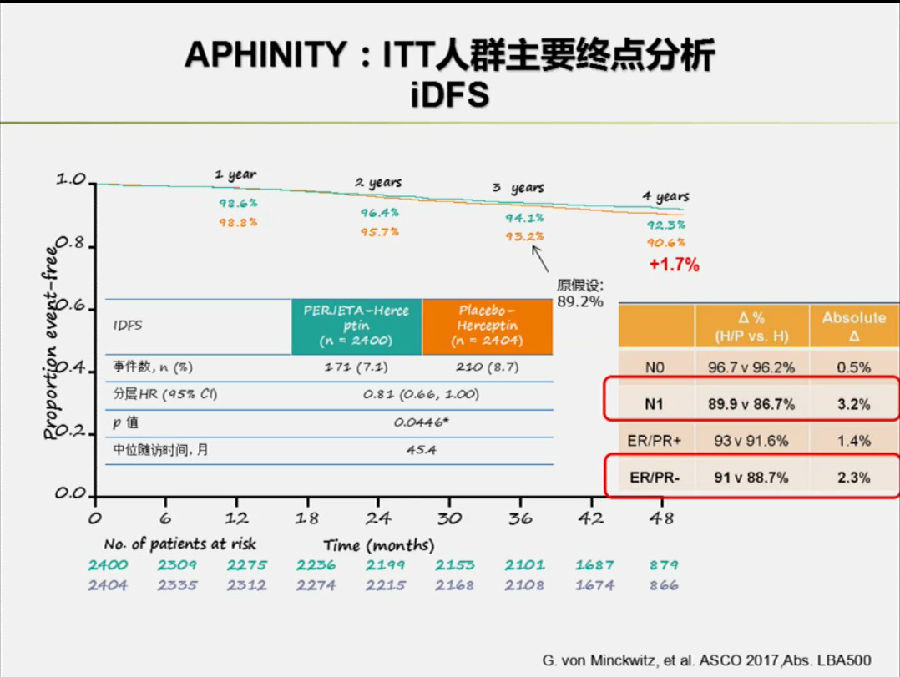
尤其是在N1亚组(改善3.2%)和激素受体阴性(HR-)亚组(改善2.3%)中,患者的获益更加明显。
如果引用一种新的治疗模式,临床医生对其改善获益的期望是比较高的。所以,我们可能会对该结果有小小的失望,因为四年iDFS提高的比例太少了。
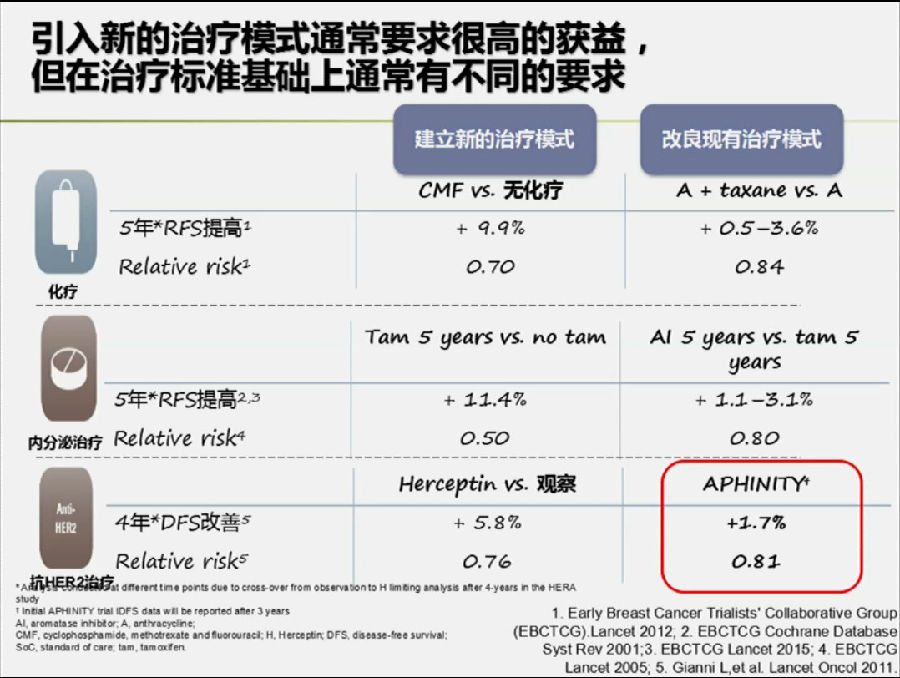
最早引入辅助化疗时,CMF方案对比安慰剂可以提高9.9%的5年无复发生存(RFS);在引入内分泌治疗时,5年他莫昔芬(TAM)较安慰剂对比可以提高11.4%的5年RFS;引入抗HER-2治疗时,曲妥珠单抗的加入也可以改善5.8%的4年DFS。
这几项研究分别奠定了当时辅助化疗、抗HER-2治疗及内分泌治疗的循证医学基础。
但是如果进一步改善标准方案的临床研究,往往都得不到那么好的数据结果(见上图)。所以APHINITY研究可以改善1.7%的iDFS,结果也还算令人满意。
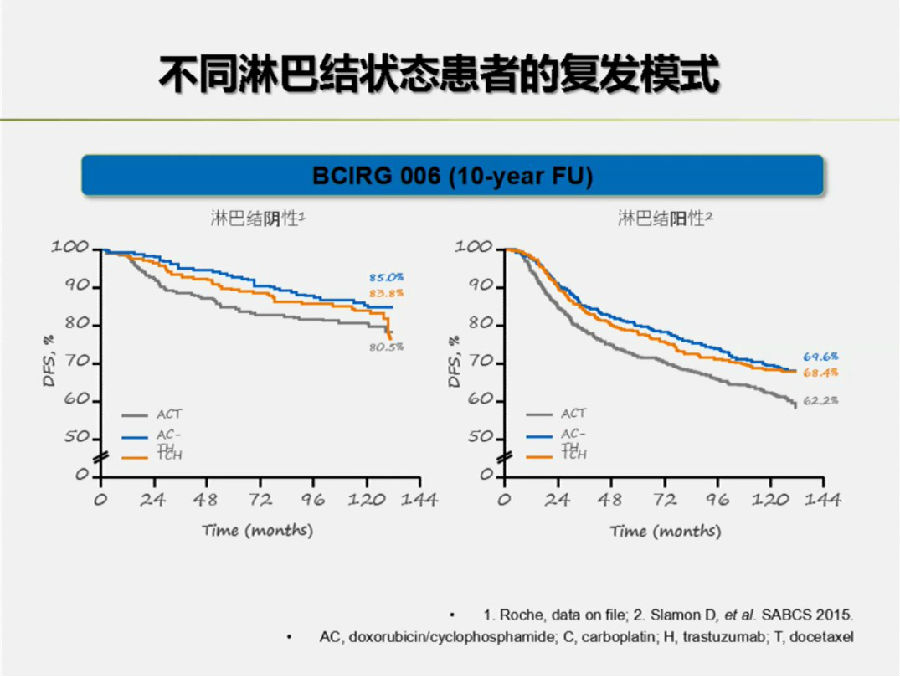
另外,既往BCIRG 006和B-31等研究表明,由于早期乳腺癌患者的生存时间很长,往往随着随访时间的进一步延长,才可以看到两组的差别逐渐拉大。
所以,殷咏梅教授对APHINITY研究进一步随访后,远期生存结果的出炉表示期待。
ALTTO研究
殷咏梅教授介绍道,在HER-2阳性乳腺癌辅助治疗中还有一些其它的尝试。在今年ASCO上也汇报了ALTTO研究(Abstract 502)的结果。
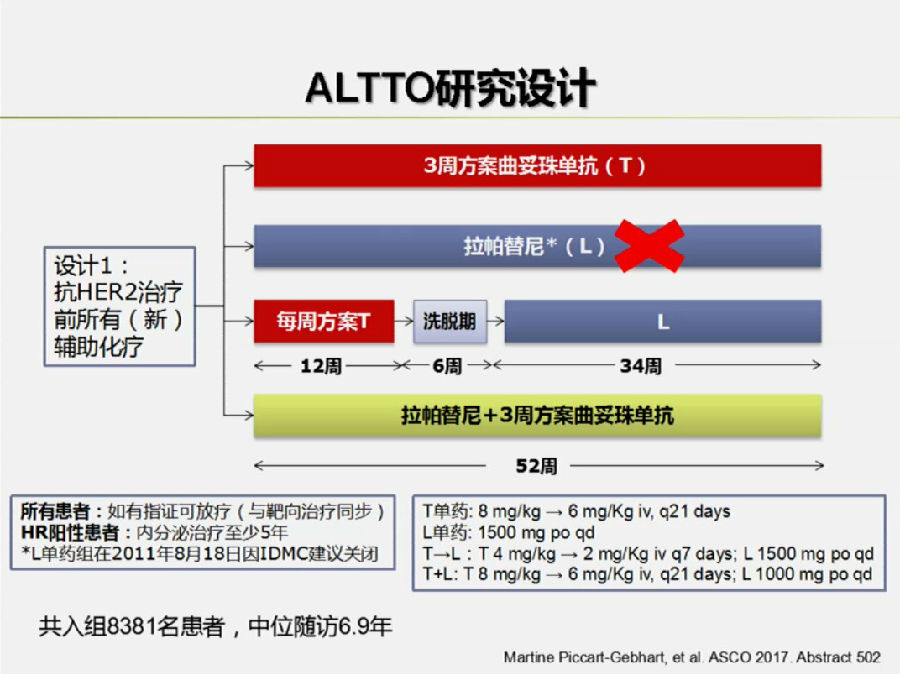
ALTTO研究目的是探究拉帕替尼联合/序贯曲妥珠单抗辅助治疗方案是否较单药曲妥珠单抗或拉帕替尼相比,可以进一步改善HER-2阳性乳腺癌的生存结局。
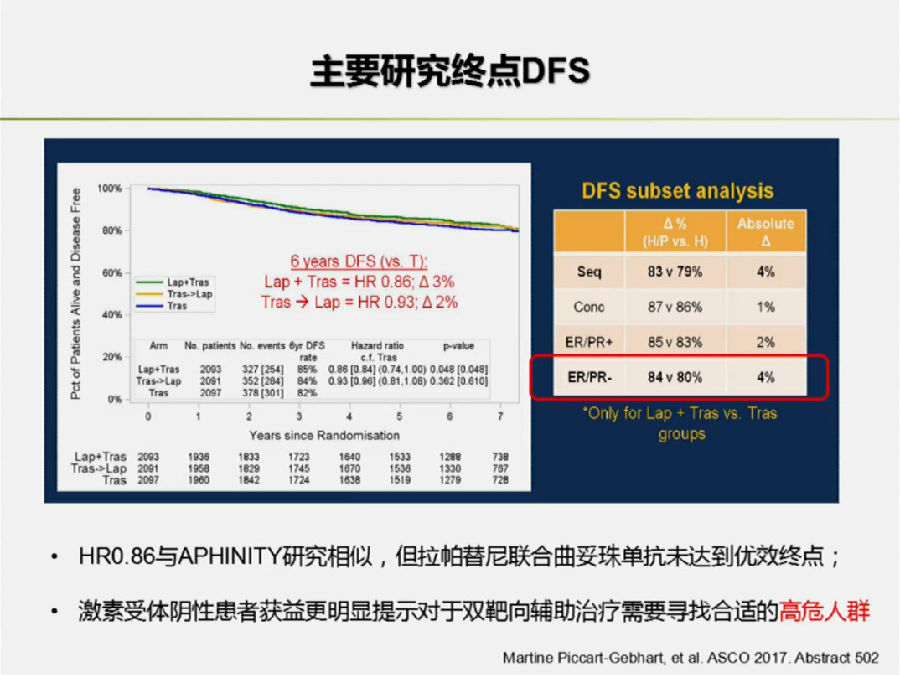
结果表明在全组患者中,拉帕替尼联合曲妥珠单抗未能达到优效终点。但是在HR-患者中,双靶向治疗对DFS的改善更加明显。
APT研究
对于HER-2+早期乳腺癌患者而言,之前的标准治疗方案为TCH方案或EC序贯TH方案。APT研究对于淋巴结阳性,肿瘤直径小于3cm的低危患者做出了减法的尝试。
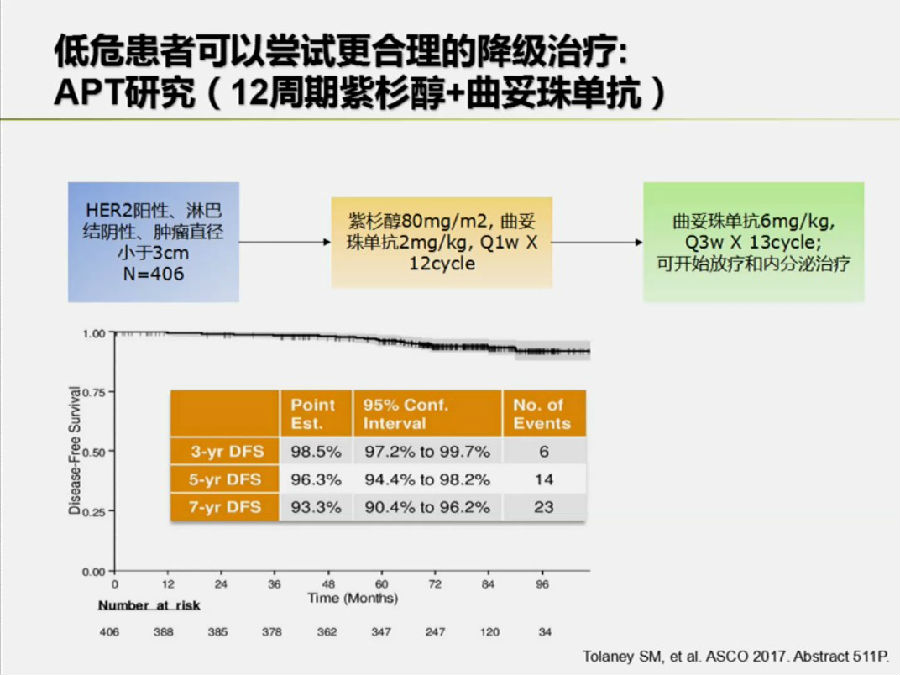
结果表明,行紫杉醇+曲妥珠单抗单周方案12个周期序贯曲妥珠单抗13周期的7年DFS也可以达到93.3%。
小结
殷咏梅教授对抗HER-2辅助治疗做出了小结:
一年曲妥珠单抗辅助治疗是目前HER-2阳性乳腺癌的辅助治疗标准,在现有治疗标准基础上改良获益难度较大;
曲妥珠单抗联合帕妥珠单抗的双靶向辅助治疗考虑高危HER-2阳性患者人群;
ER/PR阴性和淋巴结阳性患者(随访时间长,获益增加明显);
生物标志物的发展(HER-2 enriched, TILs)助力更精准选择“升级”或“降级”治疗。
辅助化疗
殷咏梅教授介绍道,2017年NCCN指南无论早期还是晚期的乳腺癌化学治疗,蒽环类仍为化疗方案的基石。

在今年ASCO汇报的PlanB研究入组的患者为高危的Her-2阴性乳腺癌,其中如果患者的病理淋巴结为阴性,必须具有高危因素(见下图)。
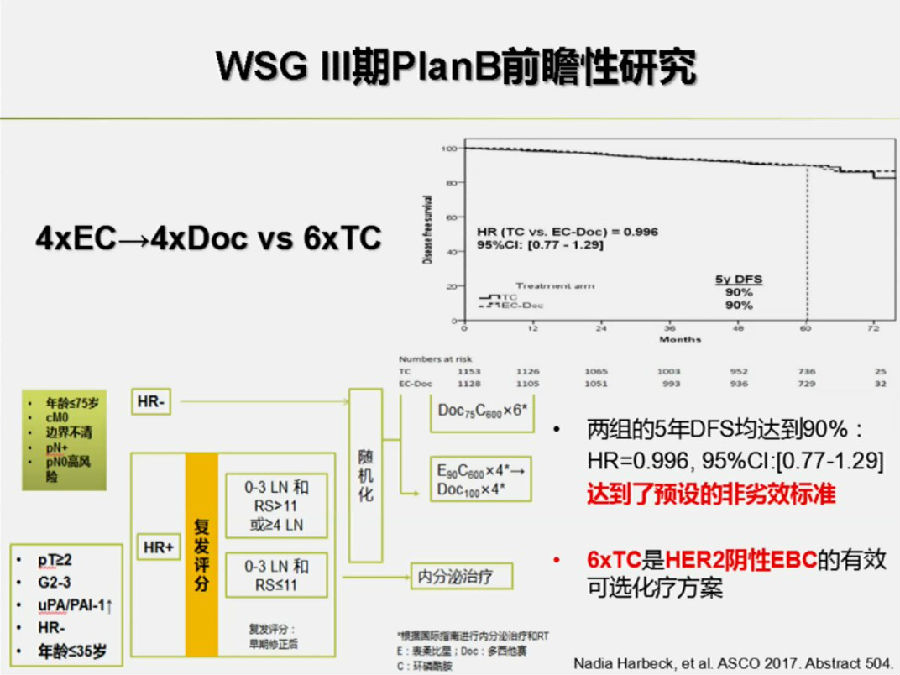
结果表明,TC组达到了预设的非劣效标准(HR, 0.996; 95%CI: 0.77-1.29),证明6周期TC方案为HER-2阴性早期乳腺癌的可选辅助化疗方案。
但是,殷咏梅教授提出:该研究与2016年ASCO上的ABC研究(3个辅助化疗临床研究的汇总分析)是矛盾的。ABC研究中,接受TAC方案患者的IDFS优于TC组(HR, 1.23; 95%CI: 1.01-1.50; p=0.04)。
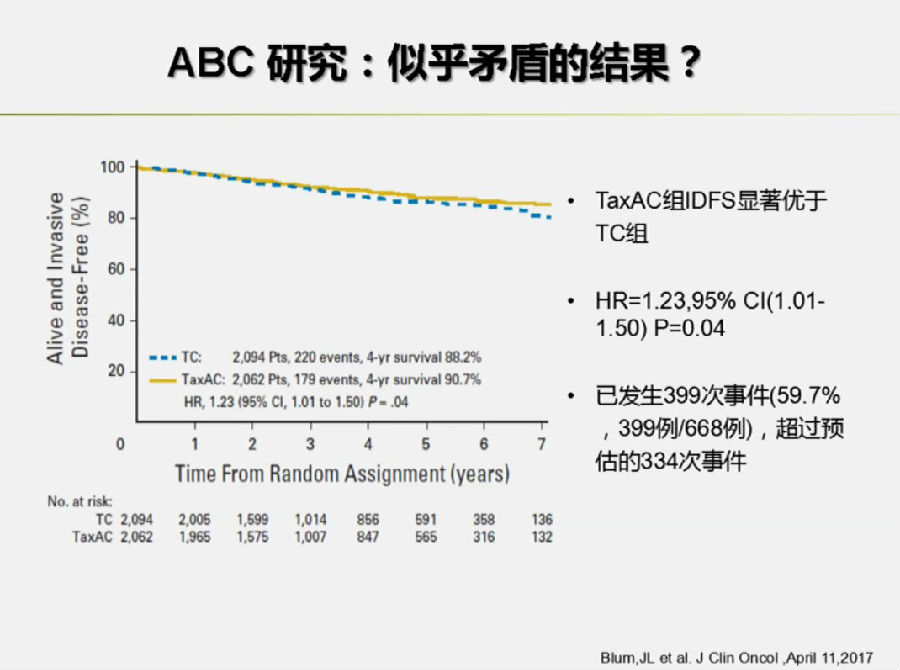
殷咏梅教授指出,这可能与入组人群的不同有一定关系。ABC研究入组的HR+人群要少于PlanB研究(69% vs 81%)。而淋巴结阴性的患者也少于PlanB研究(41% vs 59%)。
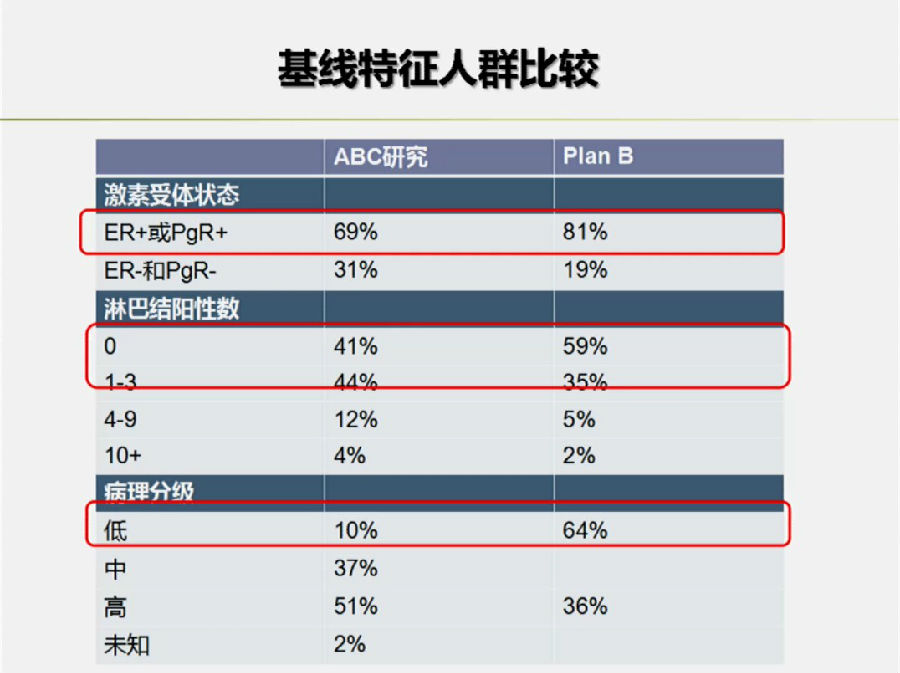
ABC研究的亚组分析表明,HR+、淋巴结阴性的HER-2阴性早期乳腺癌患者来说,TAC方案较TC方案相比,未出现出有意义的获益,并且毒副反应相对较大。
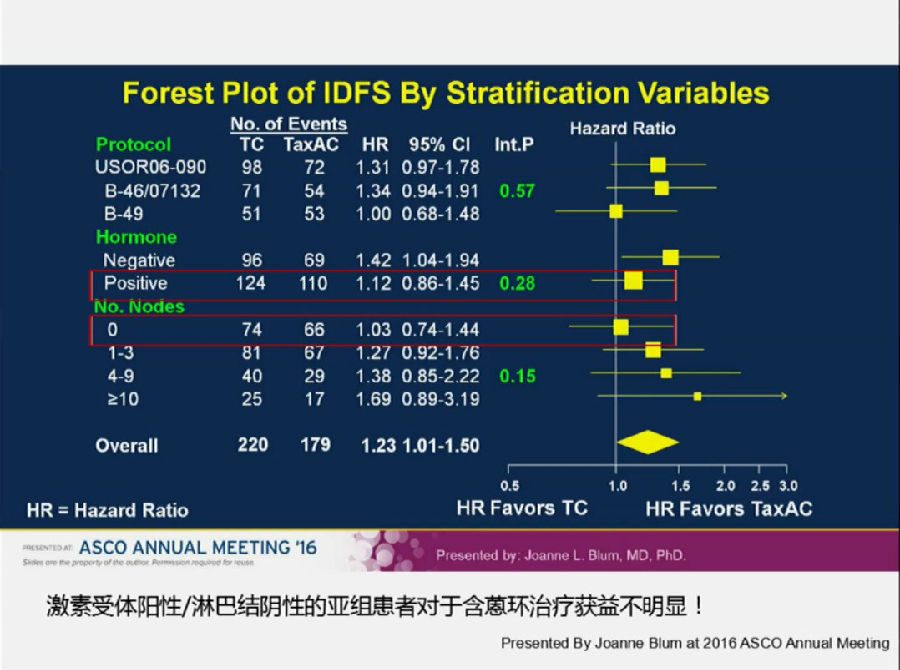
所以对于HR+,淋巴结阴性,RS<11的HER-阴性乳腺癌辅助治疗是否应用蒽环类药物值得我们深思。但是对于HR-,淋巴结阳性的高危乳腺癌患者来说,“去蒽环”方案可能为时过早。

免疫治疗
乳腺癌免疫治疗现状
乳腺癌的免疫治疗研究进程要落后于肺癌的相关研究。在去年ASCO上才报道了Atezolizumab联合白蛋白紫杉醇治疗mTNBC的 Ⅰb期研究。
今年ASCO上报道的Abstract 1008探究了Pembrolizumab单药在转移性三阴乳腺癌(mTNBC)中的一线及二线以上治疗的有效性及安全性。
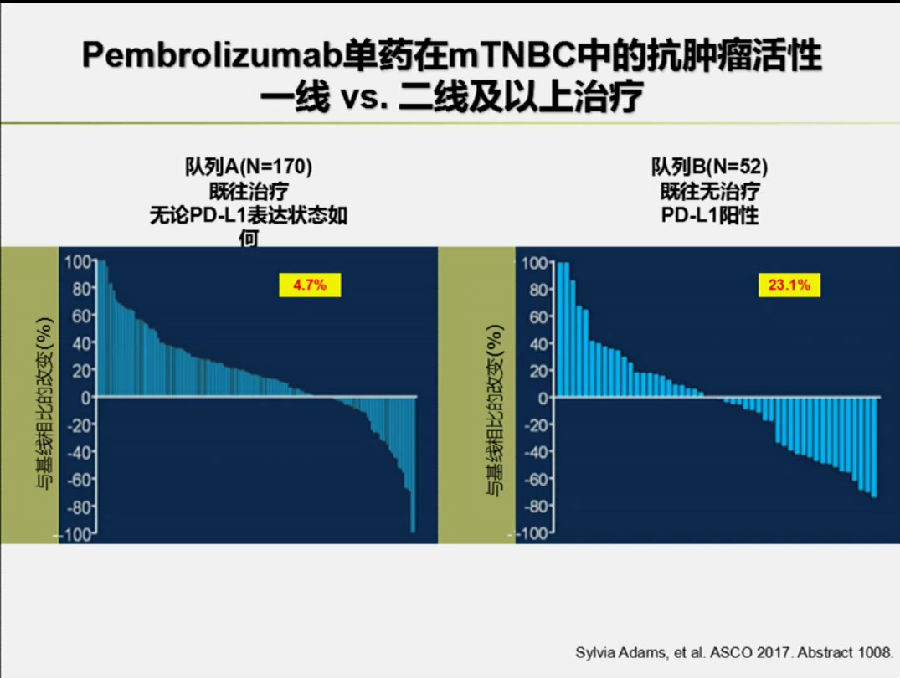
结果表明,在不筛选PD-L1表达状态mTNBC患者的二线以上治疗中,pembrolizumab的有效率为4.7%;而在PD-L1表达阳性的一线治疗中,pembrolizumab有效率为23.1%。
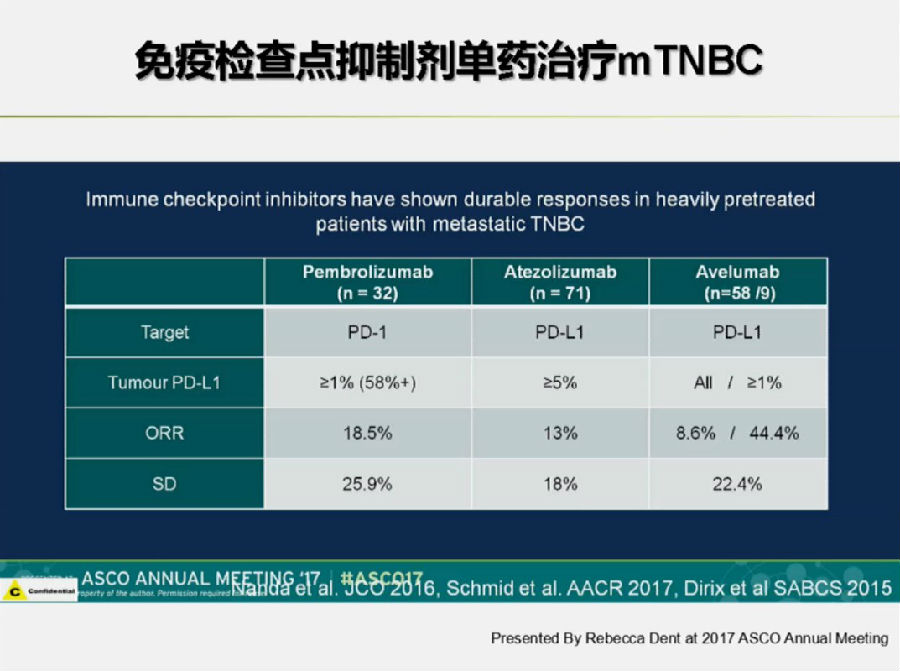
在接受多线治疗后的mTNBC中,几种免疫治疗也均显现出了较好的疗效(见上图)。目前, mTNBC一线免疫治疗最大样本研究Impassion 130也正在进行中。
本次ASCO上汇报的I-SPY2研究目的是探究免疫治疗联合化疗,在HER-2阴性早期乳腺癌新辅助治疗中的有效性与安全性。
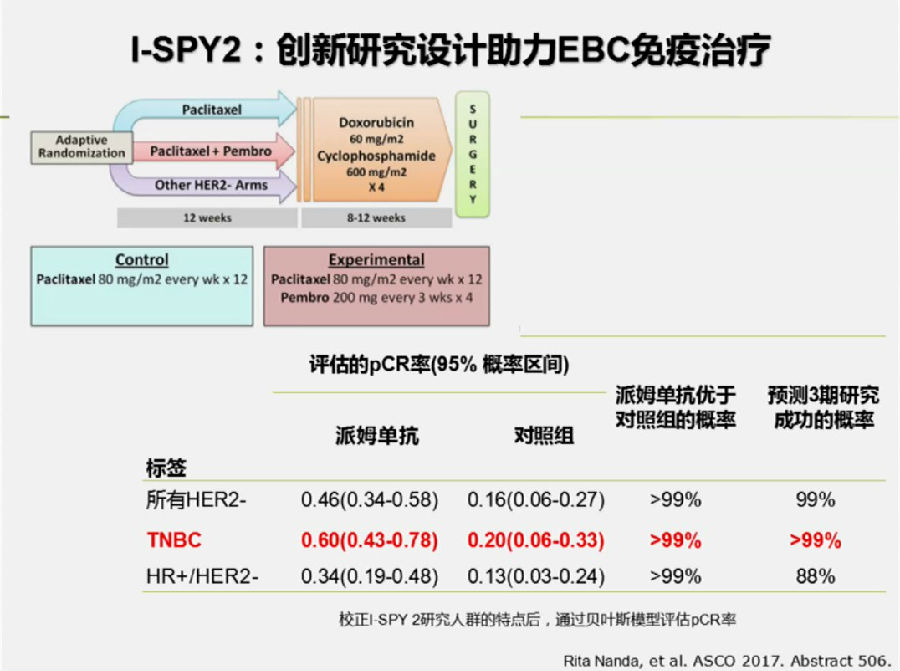
通过贝叶斯模型评估,结果表明pembrolizumab联合化疗在三阴乳腺癌中可以达到60%的PCR率,其它HER-2阴性亚组中的pCR率也高于对照组。
在辅助治疗领域,Atezolizumab在早期TNBC辅助治疗的Ⅲ期临床研究也正在开展中。
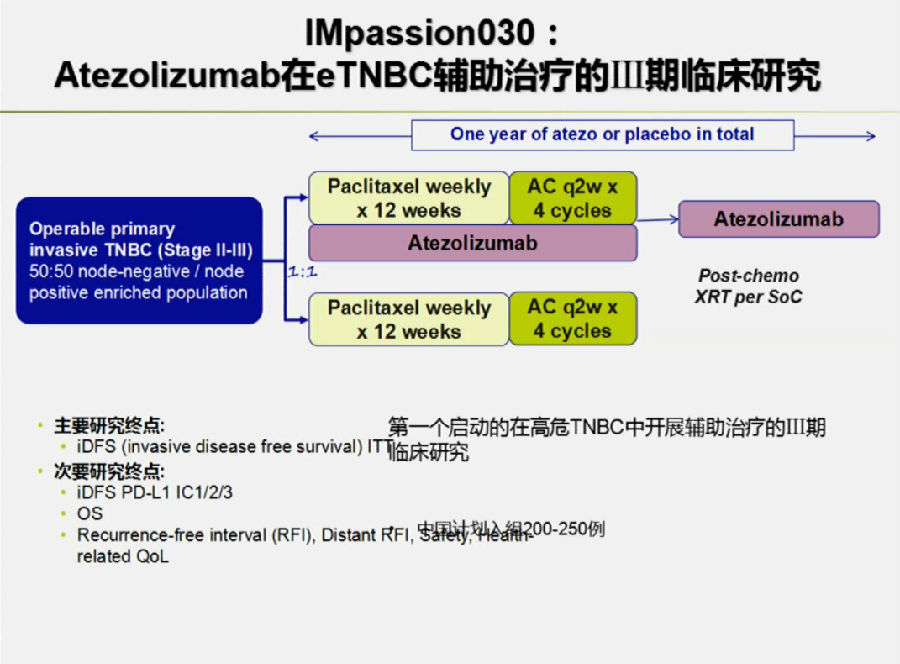
来自肺癌领域的启示
殷咏梅教授表示,肺癌免疫治疗的相关进展可以给乳腺癌研究带来很大的启示作用。
Garon教授在NEJM的Editorial上面指出,肺癌免疫治疗需要精准筛选。现有证据提示,在新的可替代标志物出现前,PD-L1表达超过50%应作为pembrolizumab一线治疗肺癌的筛选标准;
Garon教授指出,目前肿瘤突变负荷(TMB)类似发现了一种预测上赛季比赛结果的方法,至于预测本赛季比赛结果是否准确,尚存疑问。

免疫治疗根据Biomarkers筛选获益人群需要考虑各个因素,在未来应该形成统一的规范和共识。
PD-L1表达方面,Checkmate026和Keynote024两项临床研究的由于PD-L1表达Cut-off值选择(≥1% vs ≥50%)的不同,导致先期结果截然不同,也给我们带来了启示和思考。
另外,部分PD-L1阴性的患者也能从免疫治疗中获益,这也是需要考虑的问题。
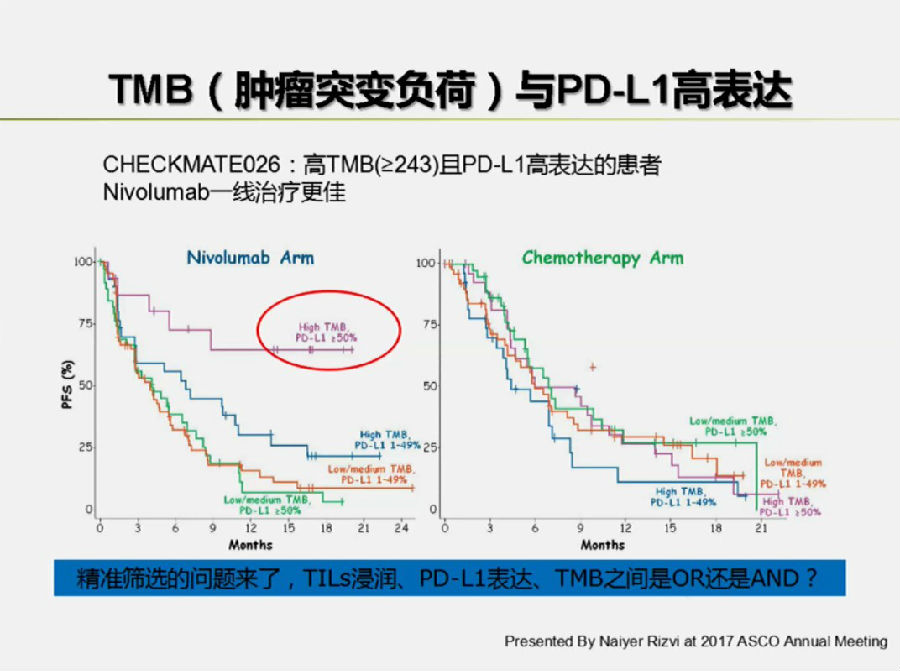
TMB方面,肿瘤是基因突变累积导致的疾病,所以突变负荷越大,表达的新抗原越多,就更容易被免疫系统所识别。
肿瘤微环境中有很多因素可以影响到免疫治疗的结果,这也是值得深思的问题。
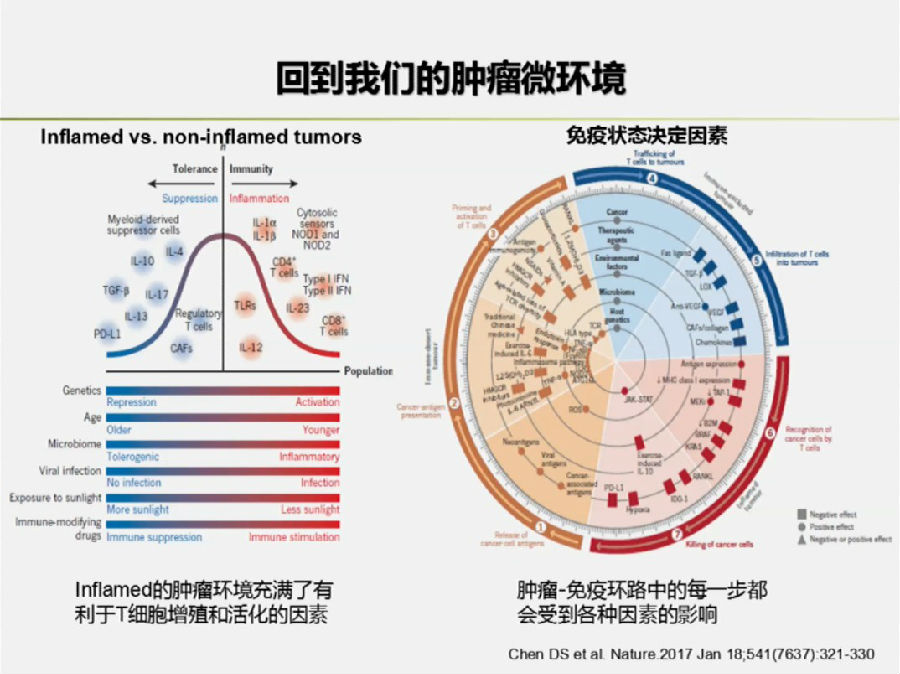
2017年Nature上将免疫细胞分为免疫炎症型,免疫豁免型和免疫沙漠型。
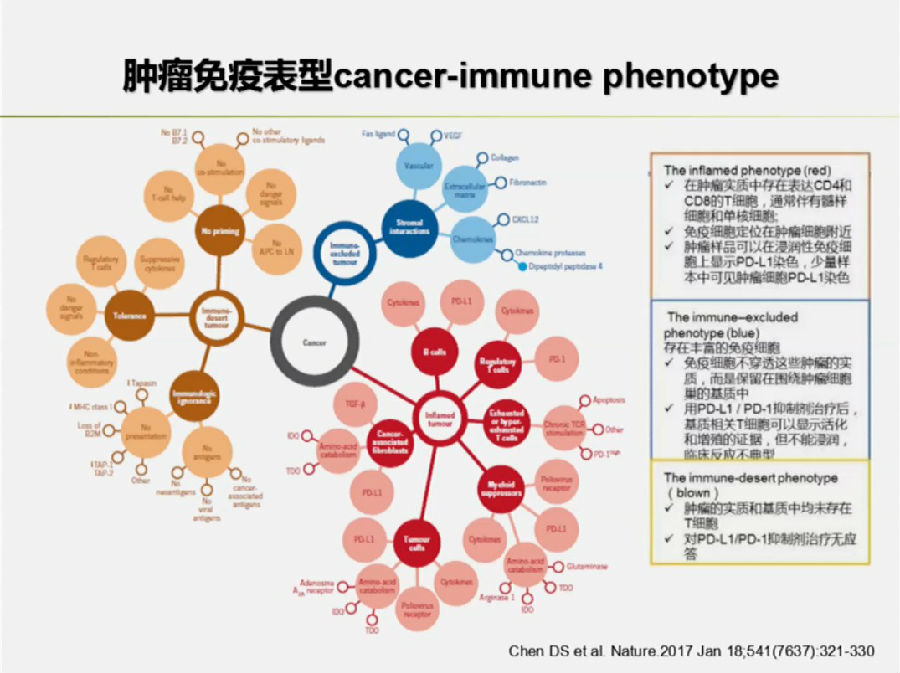
免疫炎症型可以对PD-1抑制剂高效反应,活化并浸润至肿瘤中。免疫豁免型能够被PD-1抑制剂活化,但是不能浸润至肿瘤中去。免疫沙漠型对PD-1抑制剂没有任何反应。
这也是以后值得深入研究的问题和方向。
小结
最后,殷咏梅教授对乳腺癌免疫治疗的现状与方向做出了小结:
第一,应通过Biomarkers(TILs浸润、PD-L1表达、TMB等)精确筛选受益患者;
第二,应针对合适治疗时机进行更多尝试:如在辅助治疗、一线治疗中尽早应用。
第三,是否可以模仿肺癌免疫治疗领域的思路,开展联合其它靶向药物(如抗HER-2、PARP抑制剂等)的临床研究,值得我们探索。
第四,应妥善处理免疫治疗不良反应。
