医脉通编译,转载请务必注明出处
抗血管生成和抗表皮生长因子受体(EGFR)药物在结直肠癌的姑息治疗、辅助治疗和新辅助治疗中的地位已进行广泛研究。虽然这些生物制剂在转移性结直肠癌(mCRC)一线、二线和三线治疗中的作用已经明确,但对于最佳用药顺序和患者适应症选择的争议一直存在。昨天,医脉通整理了生物治疗在结直肠癌辅助治疗和转移性结直肠癌新辅助治疗中的作用,今天继续更新,详情如下:
资讯详情》》》结直肠癌生物治疗:适应症和禁忌症(上)
生物治疗在不可切除转移性结直肠癌的作用
在转移性结直肠癌的治疗中,生物治疗的选择常需要考虑到肿瘤的基因谱。在本篇资讯中会涉及抗新生血管和抗EGFR药物在不同RAS、BRAF基因状态人群中的优劣。
生物治疗在RAS-突变型和BRAF-突变型肿瘤中的作用
约有50%的肿瘤伴有RAS突变(KRAS和NRAS第2、3、4位外显子)。但仅有5%-10%的结直肠癌患者伴有BRAF突变[1,2]。对于RAS-突变型肿瘤患者来说,在化疗外加用抗EGFR药物并无获益[3]。相反,在奥沙利铂为基础的化疗方案基础上加用西妥昔单抗,可能会对多个结局产生不利影响[1,2,4]。由于在转移性结直肠癌患者中使用贝伐珠单抗是否获益与患者的RAS或BRAF基因突变状态无关,因此尽管III期临床试验中并未基于基因状态对患者进行选择,其对使用贝伐珠单抗获益的结论可以外推到RAS-野生型和RAS-突变型肿瘤[5,6]。
靶向治疗在一线的作用
在转移性结直肠癌一线治疗中,贝伐珠单抗是唯一可以改善无疾病生存期和总生存期的抗新生血管药物。尽管相关研究并未对患者的RAS和BRAF基因状态加以选择,其研究结果仍可以外推到RAS突变型患者[5,6]。AVF2107研究是唯一的一项III期研究,其显示贝伐珠单抗可明显改善总生存期。AVF2107研究将患者随机分配,接受伊替立康和5-氟尿嘧啶/亚叶酸,分别联合或不联合贝伐珠单抗[7]。后来进行的III期一线治疗临床研究也一致证实在氟尿嘧啶基础化疗方案上加用贝伐珠单抗可额外获益,但这些研究中主要研究终点为无疾病生存期[8-10]。贝伐珠单抗纳入转移性结直肠癌一线治疗的优势在氟尿嘧啶单药治疗时最为显著。在氟尿嘧啶单药治疗基础上加用贝伐珠单抗获益最为明显[10]。在FOLFOX或XELOX方案基础上加用贝伐珠单抗可以一定程度改善无疾病生存期,但对总生存期作用不明显[8]。由于贝伐珠单抗毒性小,且对无疾病生存期的改善作用经过验证,因此建议其作为RAS-突变型或BRAF-突变型肿瘤一线用药(也可以作为RAS-野生型肿瘤的备选方案)。由于抗EGFR药物不适用于此情况,因此在该人群中贝伐珠单抗是唯一有效的靶向药物。
在BRAF-突变型转移性结直肠癌中,目前缺少充分证据表明使用抗EGFR治疗有明显临床获益[8,11]。但针对EGFR和BRAF(联合或不联合MEK)的联合靶向治疗的使用,为该人群治疗带来了巨大进展[12,13]。由于此方案仍在研究中,因此,对于该亚群患者,仍应考虑将贝伐珠单抗作为一线治疗,尽管贝伐珠单抗的疗效并不乐观。但近期TRIBE临床研究的亚组分析提示在BRAF-突变型肿瘤患者中,使用FOLFOXIRI/贝伐珠单抗与单纯FOLFIRI 比有获益。考虑到BRAF突变型肿瘤侵袭性强,在年轻体能状态好的患者中应考虑使用FOLFOXIRI/贝伐珠单抗治疗。
靶向治疗在二线的作用
ECOG3200临床研究证实了贝伐珠单抗在二线治疗的价值[14]。这些患者既往均未接受过贝伐珠单抗治疗,既往在接受伊立替康联合5-氟尿嘧啶一线治疗后疾病仍然进展。该研究中,接受FOLFOX/贝伐珠单抗治疗的患者比FOLFOX对照组缓解率高、无疾病生存期和总生存期改善(表2)。但是,在临床实际中,大部分需要二线治疗的患者既往使用过贝伐珠单抗。对于贝伐珠单抗治疗后仍进展的患者,3项随机III期临床试验报道了抗新生血管药物对这些患者的作用[14-16]。试验结果见表2。ML18147和RAISE临床研究均要求入组既往贝伐珠单抗治疗后进展患者,结果显示贝伐珠单抗和ramucirumab明显改善无疾病生存期和总生存期[17]。VELOUR临床研究包括既往接受贝伐珠单抗治疗的患者,也包括未治疗的患者。结果显示研究人群无疾病生存期和总生存期改善。以上3个试验中既往贝伐珠单抗治疗过的患者缓解率均无提高。研究的3种药物存在生物学差异,贝伐珠单抗作用靶点为VEGF-A,阿柏西普作用靶点为VEGF-A,VEGF-B和PlGF,ramucirumab作用靶点为VEGFR-2。尽管目前未对3种药物进行直接比较,但贝伐珠单抗相对最安全,而阿柏西普联合化疗出现毒性增加不得不令人关注[16]。上述三种抗新生血管药物均可考虑用于二线治疗,其中贝伐珠单抗因安全性高更受青睐。贝伐珠单抗可与不同化疗方案联用,阿柏西普和ramucirumab仅能与FOLFIRI方案联用。在二线治疗使用FOLFIRI方案时,目前尚无任何临床或生物标志物可指导3种药物的选择。
表2血管生成靶向在mCRC的二线治疗
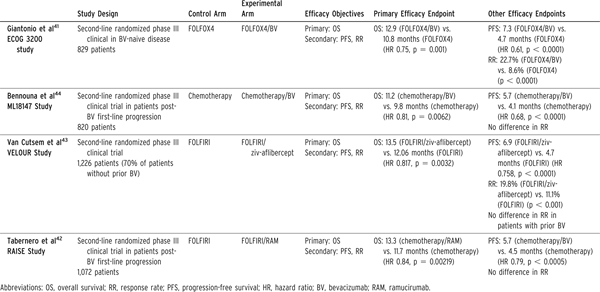
靶向治疗在化疗-难治性或耐药性结直肠癌中的作用
CORRECT临床研究入组转移性结直肠癌患者,这些患者或在使用氟尿嘧啶、奥沙利铂、伊立替康等化疗和抗EGFR(KRAS野生型)治疗后仍进展,或者不耐受这些药物[18]。所有患者既往均接受过贝伐珠单抗治疗。研究显示瑞格非尼一定程度上明显改善生存期(中位生存期6.4 vs 5个月;HR 0.77;95% CI,0.64-0.94;单侧P=0.0052)。当尝试所有标准化疗方案后疾病仍进展,可考率瑞格非尼单药治疗。
生物治疗和靶向治疗在RAS野生型肿瘤中的作用
值得注意上述提到的针对RAS或BRAF-突变型肿瘤的抗新生血管治疗同样适用于RAS/BRAF—野生型人群。另一方面,对于该人群,在一线、二线、三线等治疗中,抗EGFR治疗均证明有效。因此,对于这一人群治疗方案的选择需要考虑两种靶向药物的疗效和毒性。
靶向治疗在RAS-野生型转移性结直肠癌一线中的作用
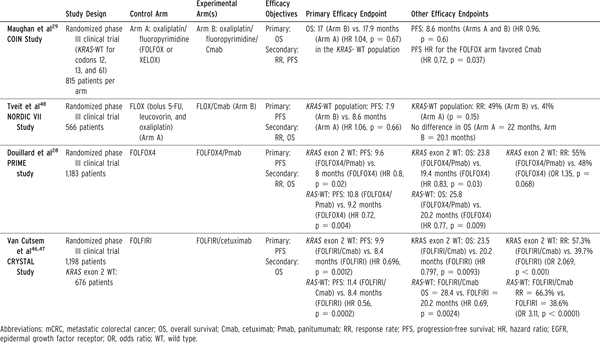
CRYSTAL临床研究对比了FOLFIRI/西妥昔单抗与FOLFIRI在一线治疗转移性结直肠癌中的疗效[19]。结果显示加用西妥昔单抗在KRAS-突变型(2号外显子)患者无额外获益,而在KRAS-野生型患者,缓解率明显提高,无疾病生存期和总生存期改善。对于RAS-野生型(除外KRAS和NRAS 2-4号外显子突变)的亚组分析显示西妥昔单抗改善无疾病生存期和总生存期作用更明显(表3)[20]。PRIME临床研究观察到类似结果,该研究使用的是FOLFOX/帕尼单抗(表3)。另外2项III期临床试验未显示西妥昔单抗在KRAS-野生型肿瘤一线治疗中有生存获益。其中NORDIC临床研究使用的是非传统的氟尿嘧啶-奥沙利铂团注给药方案[21]。COIN试验将XELOX作为基础化疗方案。由于其与西妥昔单抗联用时,毒性增加,可能干扰对西妥昔单抗疗效判断。此外,NORDIC试验中未观察到使用西妥昔单抗获益。这可能与该研究将KRAS(3、4号外显子)和NRAS突变患者纳入分析有关。西妥昔单抗对该亚群患者有不利影响,从而干扰了对整体研究人群的疗效判断。
表3EGFR靶向在mCRC的一线治疗
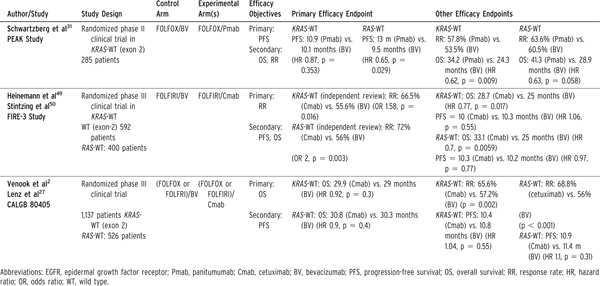
三项随机一线研究对比了贝伐单抗与抗EGFR治疗在一线治疗KRAS-野生型肿瘤中的作用(表4)[22]。三项研究的数据均来自于RAS-变态型患者。FIRE-3和CALGB 80405研究均支持抗EGFR治疗可提高缓解率,但不影响无疾病进展生存期。但2项研究中抗EGFR治疗对生存期的影响并不一致。FIRE-4临床研究显示西妥昔单抗可改善RAS-野生型肿瘤总生存期,但CALGB 80405研究中未观察到这一获益(表4)[23]。这一差别原因尚不明确。贝伐珠单抗组使用抗EGFR治疗后进展后解救率的差异可能导致了最终结果的差别。其他可能因素包括治疗依从性、剂量强度、由于药物毒性提早停药等。这些相关数据CALGB 80405研究尚未报道。PEAK临床试验是一个相对小规模的II期临床试验,比较了FOLFOX/帕尼单抗和FOLFOX/贝伐珠单抗,研究结果与FIRE-3基本一致(表4)。
表4抗-EGFR vs 贝伐珠单抗+化疗在转移性结直肠癌的一线治疗
在转移性肿瘤的一线治疗中,贝伐珠单抗和抗EGFR治疗都被认为是合理的选择。鉴于与贝伐珠单抗相比,选择抗EGFR药物一线治疗降期可能性大,因此在潜在可切除的病例里,更倾向于选择抗EGFR治疗,尤其是当FOLFOXIRI(联合或不联合贝伐珠单抗)为使用禁忌时。此外,对于穿孔风险高的人群(大块原发肿瘤,明显癌扩散)或者存在动脉栓塞风险因素的患者,更倾向于抗EGFR治疗。对于希望避免皮肤毒性患者,建议使用贝伐珠单抗。
靶向治疗在RAS野生型转移性结直肠癌二线治疗中的作用
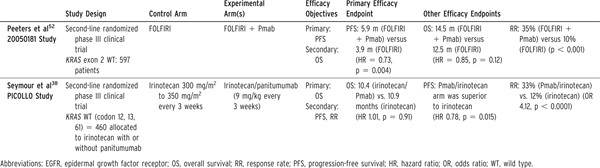
尽管抗EGFR治疗明确改善RAS野生型患者缓解率和无疾病生存期,但尚无研究表明其可以延长总生存期(表5)[24,25]。两项研究评价了伊立替康单药治疗情况下西妥昔单抗和帕尼单抗的疗效。EPIC研究对患者的选择未考虑RAS状态,但显示缓解率和无疾病生存期改善。PICCOLO研究除外了KRAS密码子12,13和61突变的患者,显示缓解率和无疾病生存期改善,但未发现总生存期改善。20050181研究随机将KRAS(外显子2)野生型患者分组,接受FOLFIRI/帕尼单抗或者FOLFIRI治疗。结果显示帕尼单抗组明显缓解率和无疾病生存期改善。该研究的最近数据进一步强调了在RAS野生型人群中使用帕尼单抗的获益(表5)[26]。
表5EGFR靶向在KRAS-野生型转移性结直肠癌的二线治疗
目前尚不清楚对于使用贝伐珠单抗为基础的一线治疗后进展的RAS野生型肿瘤进行二线治疗时,最佳生物治疗方案是什么。继续使用贝伐珠单抗或换成抗EGFR治疗(伊立替康基础的化疗方案)均可。但考虑降期时,推荐使用抗EGFR治疗。
靶向治疗在RAS野生型转移性结直肠癌三线中的作用
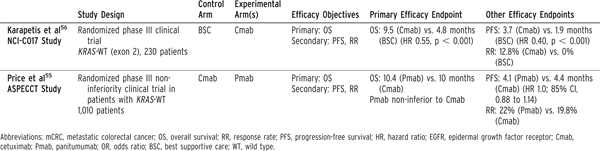
目前尚无数据支持在转移性结直肠癌三线治疗中继续使用贝伐珠单抗。对于使用所有细胞毒性化疗药物后仍进展的患者,若体能状态好且可耐受伊立替康,那么最合理的选择是抗EGFR联合伊立替康治疗[27]。参考C017和ASPECCT研究结果,此情况下使用西妥昔单抗或帕尼单抗单药治疗也可(表6)[28,29]。当所有细胞毒性和抗EGFR药物均失败或不能耐受时,可考虑瑞格非尼。值得注意的是,目前缺少关于抗EGFR再循环的随机试验数据,且推荐二线、三线治疗使用抗EGFR的临床研究中患者既往均未使用过抗EGFR药物。由于抗EGFR治疗时可出现RAS突变,因此再循环问题是一个重要的研究问题。抗EGFR治疗进展后停药相当长时间,肿瘤可能重新获得对于抗EGFR敏感性,使得重新使用抗EGFR治疗有效。一项小规模的II期临床研究支持这一观点,但需要更多研究来证实这一发现,并识别哪些患者会因此获益最大[30]。
表6EGFR靶向化疗耐药性KRAS-野生型mCRC
参考文献:
[1]Douillard JY, Oliner KS, Siena S, et al. Panitumumab-FOLFOX4 treatment and RAS mutations in colorectal cancer. N Engl J Med. 2013;369:1023-1034.
[2]Maughan TS, Adams RA, Smith CG, et al. Addition of cetuximab to oxaliplatin-based first-line combination chemotherapy for treatment of advanced colorectal cancer: results of the randomised phase 3 MRC COIN trial. Lancet. 2011;377:2103-2114.
[3]Sorich MJ, Wiese MD, Rowland A, et al. Extended RAS mutations and anti-EGFR monoclonal antibody survival benefit in metastatic colorectal cancer: a meta-analysis of randomized, controlled trials. Ann Oncol. 2015;26:13-21.
[4]Schwartzberg LS, Rivera F, Karthaus M, et al. PEAK: a randomized, multicenter phase II study of panitumumab plus modified fluorouracil, leucovorin, and oxaliplatin (mFOLFOX6) or bevacizumab plus mFOLFOX6 in patients with previously untreated, unresectable, wild-type KRAS exon 2 metastatic colorectal cancer. J Clin Oncol. 2014;32:2240-2247.
[5]Hurwitz HI, Yi J, Ince W, et al. The clinical benefit of bevacizumab in metastatic colorectal cancer is independent of K-ras mutation status: analysis of a phase III study of bevacizumab with chemotherapy in previously untreated metastatic colorectal cancer. Oncologist. 2009;14:22-28.
[6]Price TJ, Hardingham JE, Lee CK, et al. Impact of KRAS and BRAF gene mutation status on outcomes from the phase III AGITG MAX trial of capecitabine alone or in combination with bevacizumab and mitomycin in advanced colorectal cancer. J Clin Oncol. 2011;29:2675-2682.
[7]Hurwitz H, Fehrenbacher L, Novotny W, et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med. 2004;350:2335-2342.
[8]Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab in combination with oxaliplatin-based chemotherapy as first-line therapy in metastatic colorectal cancer: a randomized phase III study. J Clin Oncol. 2008;26:2013-2019.
[9]Tebbutt NC, Wilson K, Gebski VJ, et al. Capecitabine, bevacizumab, and mitomycin in first-line treatment of metastatic colorectal cancer: results of the Australasian Gastrointestinal Trials Group Randomized Phase III MAX Study. J Clin Oncol. 2010;28:3191-3198.
[10]Cunningham D, Lang I, Marcuello E, et al. Bevacizumab plus capecitabine versus capecitabine alone in elderly patients with previously untreated metastatic colorectal cancer (AVEX): an open-label, randomised phase 3 trial. Lancet Oncol. 2013;14:1077-1085.
[11]Seymour MT, Brown SR, Middleton G, et al. Panitumumab and irinotecan versus irinotecan alone for patients with KRAS wild-type, fluorouracil-resistant advanced colorectal cancer (PICCOLO): a prospectively stratified randomised trial. Lancet Oncol. 2013;14:749-759.
[12]Hong D, Morris V, Fu S, et al. Phase 1B study of vemurafenib in combination with irinotecan and cetuximab in patients with BRAF-mutated advanced cancers and metastatic colorectal cancer. J Clin Oncol. 2014;32:5s, (suppl; abstr 3516).
[13]Corcoran R, Atreya C, Falchook G, et al. Phase 1-2 trial of the BRAF inhibitor dabrafenib (D) plus MEK inhibitor trametinib (T) in BRAF V600 mutant colorectal cancer (CRC): updated efficacy and biomarker analysis. J Clin Oncol. 2014;32:5s (suppl; abstr 3517).
[14]Giantonio BJ, Catalano PJ, Meropol NJ, et al. Bevacizumab in combination with oxaliplatin, fluorouracil, and leucovorin (FOLFOX4) for previously treated metastatic colorectal cancer: results from the Eastern Cooperative Oncology Group Study E3200. J Clin Oncol. 2007;25:1539-1544.
[15]Tabernero J, Cohn A, Obermannova R, et al. RAISE: a randomized, double-blind, multicenter phase III study of irinotecan, folinic acid, and 5-fluorouracil (FOLFIRI) plus ramucirumab (RAM) or placebo (PBO) in patients (pts) with metastatic colorectal carcinoma (CRC) progressive during or following first-line combination therapy with bevacizumab (bev), oxaliplatin (ox), and a fluoropyrimidine (fp). J Clin Oncol. 2015;33:3s (suppl; abstr 512).
[16]Van Cutsem E, Tabernero J, Lakomy R, et al. Addition of aflibercept to fluorouracil, leucovorin, and irinotecan improves survival in a phase III randomized trial in patients with metastatic colorectal cancer previously treated with an oxaliplatin-based regimen. J Clin Oncol. 2012;30:3499-3506.
[17]Bennouna J, Sastre J, Arnold D, et al. Continuation of bevacizumab after first progression in metastatic colorectal cancer (ML18147): a randomised phase 3 trial. Lancet Oncol. 2013;14:29-37.
[18]Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2013;381: p. 303-312.
[19]Van Cutsem E, Köhne CH, Hitre E, et al. Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer. N Engl J Med. 2009;360:1408-1417.
[20]Ciardiello F, Lenz H, Kohne C, et al. Treatment outcome according to tumor RAS mutation status in CRYSTAL study patients with metastatic colorectal cancer (mCRC) randomized to FOLFIRI with/without cetuximab. J Clin Oncol. 2014;32:5s (suppl; abstr 3506).
[21]Tveit KM, Guren T, Glimelius B, et al. Phase III trial of cetuximab with continuous or intermittent fluorouracil, leucovorin, and oxaliplatin (Nordic FLOX) versus FLOX alone in first-line treatment of metastatic colorectal cancer: the NORDIC-VII study. J Clin Oncol. 2012;30:1755-1762.
[22]Heinemann V, von Weikersthal LF, Decker T, et al. FOLFIRI plus cetuximab versus FOLFIRI plus bevacizumab as first-line treatment for patients with metastatic colorectal cancer (FIRE-3): a randomised, open-label, phase 3 trial. Lancet Oncol. 2014;15:1065-1075.
[23]Stintzing S, Modest D, Fischer von Weikersthal L, et al. Independent radiological evaluation of objective response, early tumor shrinkage, and depth of response in FIRE-3 (AIO KRK-0306) in the final RAS evaluable population. Ann Oncol. 2014;25:1-41 LBA11.
[24]Sobrero AF, Maurel J, Fehrenbacher L, et al. EPIC: phase III trial of cetuximab plus irinotecan after fluoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol. 2008;26:2311-2319.
[25]Peeters M, Price TJ, Cervantes A, et al. Randomized phase III study of panitumumab with fluorouracil, leucovorin, and irinotecan (FOLFIRI) compared with FOLFIRI alone as second-line treatment in patients with metastatic colorectal cancer. J Clin Oncol. 2010;28:4706-4713.
[26]Peeters M, Oliner K, Price T, et al. Updated analysis of KRAS/NRAS and BRAF mutations in study 20050181 of panitumumab (pmab) plus FOLFIRI for second-line treatment (tx) of metastatic colorectal cancer (mCRC). J Clin Oncol. 2014;32:5s (suppl; abstr 3568).
[27]Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med. 2004;351:337-345.
[28]Price TJ, Peeters M, Kim TW, et al. Panitumumab versus cetuximab in patients with chemotherapy-refractory wild-type KRAS exon 2 metastatic colorectal cancer (ASPECCT): a randomised, multicentre, open-label, non-inferiority phase 3 study. Lancet Oncol. 2014;15:569-579.
[29]Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med. 2008;359:1757-1765.
[30]Santini D, Vincenzi B, Addeo R, et al. Cetuximab rechallenge in metastatic colorectal cancer patients: how to come away from acquired resistance? Ann Oncol. 2012;23:2313-2318.
医脉通编译自:Biologic Therapies in Colorectal Cancer: Indications and Contraindications,2015 ASCO Educational Book
